
| A. | 0.225mol/L | B. | 0.25mol/L | C. | 0.45mol/L | D. | 0.55mol/L |
分析 H2SO4、Al2(SO4)3、K2SO4和明矾的混和溶液中,加入等体积的0.6mol/L的KOH溶液时,氢离子先参加反应,需要消耗氢氧化钾的浓度为0.2mol/L,与铝离子反应的氢氧根离子浓度为:0.6mol/L-0.2mol/L=0.4mol/L,生成的沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,可知原溶液中c(Al3+)=$\frac{1}{4}$×0.4mol/L=0.1mol/L,由电荷守恒可知溶液中:c(H+)+c(K+)+3c(Al3+)=2c(SO42-),据此进行计算反应前溶液中钾离子浓度,再根据钾离子不反应计算出反应后溶液中K+的浓度,注意反应后溶液的体积扩大一倍.
解答 解:H2SO4、Al2(SO4)3、K2SO4和明矾的混和溶液中,加入等体积的0.6mol/L的KOH溶液时,氢离子优先反应,0.2mol/L的氢离子消耗0.2mol/L的氢氧根离子,则与铝离子反应的氢氧根离子的浓度为:0.6mol/L-0.2mol/L=0.4mol/L;
生成的沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,可知原溶液中c(Al3+)=$\frac{1}{4}$×0.4mol/L=0.1mol/L,
根据电荷守恒可知,原溶液中:c(H+)+c(K+)+3c(Al3+)=2c(SO42-),即c(K+)=2c(SO42-)-3c(Al3+)-c(H+)=2×0.5mol/L-0.1mol/L×3-0.2mol/L=0.5mol/L;
设溶液体积为V,反应前后钾离子的物质的量不变,则反应后溶液中K+的浓度约为:c(K+)=$\frac{0.5mol/L×V+0.6mol/L×V}{2V}$=0.55mol/L,
故选D.
点评 本题考查混合物反应的计算,题目难度中等,注意掌握物质的量浓度的概念及计算方法,明确铝离子与氢氧根离子反应的方程式,本题中正确计算出溶液中铝离子浓度为解题关键,注意氢离子优先消耗氢氧根离子、反应后溶液体积扩大为原先的2倍.


科目:高中化学 来源: 题型:选择题
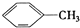
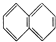
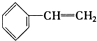
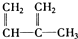
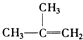
| A. | ④和⑧ | B. | ①、②和③ | C. | ④和⑤ | D. | ④、⑥和⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一密闭容器中进行以下可逆反应:M(g)+N(g)?P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则反应( )
在一密闭容器中进行以下可逆反应:M(g)+N(g)?P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则反应( )| A. | 正反应放热,L是固体 | B. | 正反应放热,L是气体 | ||
| C. | 正反应吸热,L是气体 | D. | 正反应吸热,L是固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X中有两种溶质 | |
| B. | Y通入纯水中得到酸性溶液 | |
| C. | 原混合粉末的总质量小于7.8g | |
| D. | 当V=1680时,原混合粉末中Cu和Cu2O的物质的量之比为8:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2016年命名的含有173个中子的113号元素:${\;}_{113}^{173}$Nh | |
| B. | 对硝基甲苯的结构简式: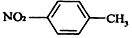 | |
| C. | CSO的电子式: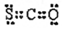 | |
| D. | F-的离子结构示意图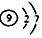 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com