
 A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:
A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答: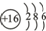
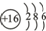
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+ 2NH3
2NH3 2NH3
2NH3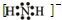
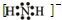
| 4(m-n) |
| 5 |
| 4(m-n) |
| 5 |
| 4n+m |
| 5 |
| 4n+m |
| 5 |
| 4m+3n |
| 5 |
| 4m+3n |
| 5 |
| m-3n |
| 5 |
| m-3n |
| 5 |
| 38 |
| 3 |
| 40 |
| 3 |
| 22 |
| 3 |

| 38 |
| 3 |
| 40 |
| 3 |
| 22 |
| 3 |
 ,故答案为:
,故答案为: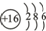 ;
; NH3?H2O+H+,溶液呈酸性,
NH3?H2O+H+,溶液呈酸性, NH3?H2O+H+;
NH3?H2O+H+;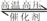 2NH3,该反应为放热反应,温度升高平衡向逆反应方向移动,但在较高温度下,反应速率较大,且催化剂具有较强活性,NH3液态时可发生微弱电离:2NH3
2NH3,该反应为放热反应,温度升高平衡向逆反应方向移动,但在较高温度下,反应速率较大,且催化剂具有较强活性,NH3液态时可发生微弱电离:2NH3 NH4++NH2-,NH2-的电子式为
NH4++NH2-,NH2-的电子式为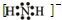 ,
,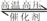 2NH3;加快反应速率,催化剂活性有效温度;
2NH3;加快反应速率,催化剂活性有效温度;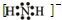 ;
;| 4(m-n) |
| 5 |
| (m-n) |
| 5 |
| 4n+m |
| 5 |
| 4(m-n) |
| 5 |
| 4n+m |
| 5 |
| 4(m-3n) |
| 5 |
| 4m+3n |
| 5 |
| m-3n |
| 5 |
| 4m+3n |
| 5 |
| m-3n |
| 5 |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | |
| C | D |
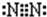
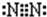

查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
| △ |
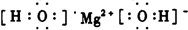
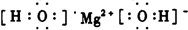
| △ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
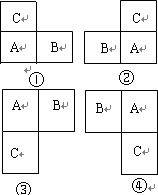
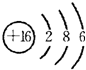
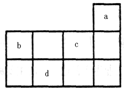 a、b、c、d均为短周期元素,它们在周期表中的位置如图所示.下列说法正确的是( )
a、b、c、d均为短周期元素,它们在周期表中的位置如图所示.下列说法正确的是( )| A、a原子的最外电子层上有8个电子 | B、c的最高价氧化物对应水化物为强酸 | C、d的原子半径比c的大 | D、b的非金属性比c的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com