
分析 (1)二氧化氮与与水反应生成一氧化氮和硝酸;
(2)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水;
(3)氨气具有还原性,氧气具有氧化性,氨气中氮元素为-3价,被氧气氧化为+2价的氮元素,所以氨气和氧气反应生成一氧化氮和水;
(4)铜和稀硝酸反应生成硝酸铜,一氧化氮和水;
(5)铜和浓硝酸反应生成硝酸铜,二氧化氮和水.
解答 解:(1)二氧化氮与水反应生成一氧化氮和硝酸,反应的化学方程式为3NO2+H2O═2HNO3+NO,
故答案为:3NO2+H2O═2HNO3+NO;
(2)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,反应的方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)NH3与过量O2在催化剂、加热条件下发生反应生成一氧化氮和水,反应方程为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(4)铜具有还原性,稀硝酸具有氧化性,铜与稀硝酸发生氧化还原反应,生成硝酸铜,一氧化氮和水,反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O.
(5)铜具有还原性,浓硝酸具有氧化性,铜与浓硝酸发生氧化还原反应,生成硝酸铜,二氧化氮和水,反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
点评 本题考查了化学方程式的书写,是高考常见题型,题目难度不大,熟悉化学反应的实质是书写方程式的关键.


科目:高中化学 来源: 题型:选择题

| A. | ①表示化学反应H2(g)+Cl2(g)═2HCl(g)的能量变化,则该反应的反应热△H=+183 kJ/mol | |
| B. | ②表示其他条件不变时,反应4A(g)+3B(g)?2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是气体 | |
| C. | ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 | |
| D. | ④表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
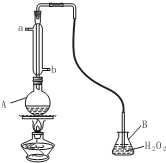 工业制硫酸尾气中的SO2,是一种空气污染物,同时也是一种重要的化工原料,采用氨吸收法进行循环利用,便可以变废为宝.
工业制硫酸尾气中的SO2,是一种空气污染物,同时也是一种重要的化工原料,采用氨吸收法进行循环利用,便可以变废为宝.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
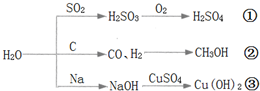
| A. | 图中所示的反应均为氧化还原反应 | |
| B. | 途径①是硫酸型酸雨的形成的重要途径 | |
| C. | 工业上可用途径②先制取水煤气,再合成甲醇等有机物 | |
| D. | 把金属钠投入到硫酸铜溶液中,发生途径③反应,反应不生成铜单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙炔是以乙炔为单体发生加聚反应形成的高聚物 | |
| B. | 聚乙炔的化学式为 ,其分子中所有碳原子不可能在同一直线上 ,其分子中所有碳原子不可能在同一直线上 | |
| C. | 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质 | |
| D. | 1摩尔聚乙炔能与1摩尔Br2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | VA=0.15 mol•L-1•min-1 | B. | VB=0.6 mol•L-1•min-1 | ||
| C. | VC=0.4 mol•L-1•min-1 | D. | VD=0.1 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)随着温度升高而降低 | B. | 在35℃时,c(H+)>c(OH-) | ||
| C. | 蒸馏水中通HCl,Kw增大 | D. | 温度升高有利于水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,Y
,Y .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com