
【题目】防止水体污染,改善水质,最根本的措施是控制工业废水和生活污水的排放。有一种工业废水,已知其中含有大量的Fe2+和SO42-,少量的Ag+和Na+,以及部分污泥。某校化学兴趣小组同学通过下列操作过程,回收物质,处理废水。
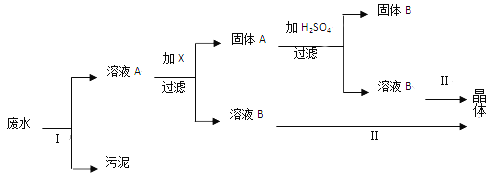
根据上述操作过程,回答下列问题:
(1)在实验室进行Ⅰ操作时,需要的主要玻璃仪器有_______________。
(2)操作Ⅱ的名称是_____________。
(3)向溶液A中需要加入过量X,X是________________,发生反应的离子方程式为___________。
(4)上述操作回收到的固体B是________________,晶体是_________________。(两空均写名称)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。如图是一套制取并验证氯气部分化学性质的实验装置。已知:Cl2+2KI=I2+2KCl。
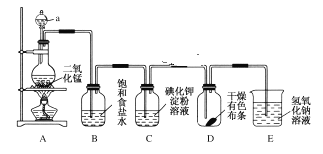
(1)写出实验室制取氯气反应的化学方程式___。
(2)装置B的作用是___。
(3)当有少量Cl2通过后,观察到装置C中溶液变成___色。
(4)当Cl2持续通过时,装置D中干燥的有色布条能否褪色?为什么?__。
(5)若要证明Cl2无漂白性,则必须在装置D之前加一个装有__的洗气瓶。
(6)装置E的作用是__,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究。

已知废水试样中可能含有下表中的离子:
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO、Y、NO |
(1)离子X是________(填化学式,下同),离子Y是________。
(2)表中不能确定是否存在的阴离子是________,能证明该阴离子是否存在的简单实验操作为______________________________________________
(3)丁组实验在酸性条件下发生反应的离子方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极。电解过程中,电极b和d上
没有气体逸出,但质量均增大,且增重b>d。符合上述实验结果的盐溶液是

选项 | X | Y |
A | MgSO4 | CuSO4 |
B | AgNO3 | Pb(NO3)2 |
C | FeSO4 | Al2 (SO4)3 |
D | CuSO4 | AgNO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学配制240mL 1.00mol·L-1 Na2CO3溶液,请回答有关问题。
(1)配制时,下列4个操作的顺序是(用序号表示,每个操作只能用一次)____。
①将已冷却的Na2CO3溶液沿玻璃棒注入____中;
②用天平准确称取____g Na2CO3固体,加入少量蒸馏水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解;
③塞上瓶塞,颠倒摇匀;
④继续往容量瓶内小心加水,直到液面接近刻度____处,改用____加水至溶液凹液面与刻度线相切。
(2)按上述步骤配制的Na2CO3溶液的浓度____(选填“是”或“不是”)1.00mol·L-1,理由是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质均为a g,将它们在氧气中完全燃烧的产物全部通入到足量的过氧化钠固体中,则过氧化钠固体增重为a g的是( )
①CO ②H2 ③CH4 ④HCHO ⑤CH3COOH ⑥HCOOH
A. ①②⑥ B. ③④⑤ C. ①②④⑤ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。所用仪器如图:
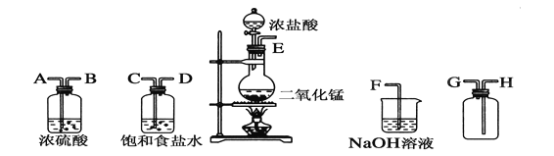
(1)连接上述仪器的正确顺序(填各接口处的字母):__接__;__接__;__接__;__接__。
(2)装置中,饱和食盐水的作用是______________;NaOH溶液的作用是____________。
(3)写出下列化学反应的方程式。
①气体发生装置中进行的反应:________________________________________。
②NaOH溶液中发生的反应:__________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4℃时,100mL水中溶解了33.6L(STP)HCl气体,所得盐酸密度为1.18g·mL﹣1。下列有关说法不正确的是( )
A.该盐酸的物质的量浓度为15mol·L﹣1
B.该盐酸溶质的质量分数为35.4%
C.该温度下HCl的溶解度可能大于336(气体溶解度以体积比计算)
D.相同条件下,一定量水中溶解HCl气体越多,所得盐酸密度越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com