
| A. | 在反应KC1O3+6HCl(浓)═KC1+3C12↑+3H2O中,每生成3 mol Cl2转移的电子数为NA | |
| B. | 1 mol K2S固体中含有3 NA个离子 | |
| C. | 1 mol 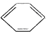 分子中含碳碳双键数为3 NA 分子中含碳碳双键数为3 NA | |
| D. | 含有NA个氖原子的氖气在标准状况下的体积约为11.2 L |
分析 A、反应KC1O3+6HCl(浓)═KC1+3C12↑+3H2O转移5mol电子,生成3mol氯气;
B、K2S由2个钾离子和1个硫离子构成;
C、苯不是单双键交替的结构;
D、氖气为单原子分子.
解答 解:A、反应KC1O3+6HCl(浓)═KC1+3C12↑+3H2O转移5mol电子,生成3mol氯气,故当生成3mol氯气时转移5mol电子即5NA个,故A错误;
B、K2S由2个钾离子和1个硫离子构成,故1mol硫化钾中含3mol离子即3NA个,故B正确;
C、苯不是单双键交替的结构,故苯中无碳碳双键,故C错误;
D、氖气为单原子分子,故含有NA个氖原子的氖气的物质的量为1mol,在标况下为22.4L,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
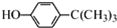 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下: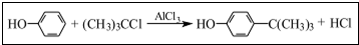 .该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.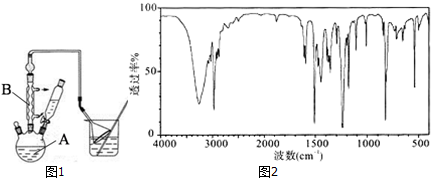
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大O2的浓度能加快反应速率 | B. | 降低体系温度能加快反应速率 | ||
| C. | 使用催化剂不影响反应速率 | D. | 一定条件下SO2能100%转化为SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
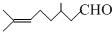 )是合成青蒿素原料之一.
)是合成青蒿素原料之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥ | B. | ②④⑤⑥ | C. | ③⑤ | D. | ③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水代替碘水进行萃取实验 | |
| B. | 用过量的氯气进行性质实验 | |
| C. | 用乙烯和氧气在银作催化剂的条件下制备环氧乙烷 | |
| D. | 用铜粉代替铜丝进行铜和浓硝酸反应的实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯化锌溶液中投入钠 | B. | 氯化铁溶液中投入铜 | ||
| C. | 硝酸银溶液中投入铜 | D. | 硫酸铜溶液中投入铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 草酸的体积/mL | 温度/℃ | 其它物质 |
| ① | 2mL | 20 | |
| ② | 2mL | 20 | 2滴饱和MnSO4溶液 |
| ③ | 2mL | 30 | |
| ④ | 1mL | 20 | 1mL蒸馏水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com