
【题目】有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验.按如表所示的量和反应条件在三颈瓶中加入一定量P2O5 , 再注入95%的乙醇,并加热,观察现象.
实验 | P2O5/g | 95%乙醇量/mL | 加热方式 |
实验1 | 2 | 4 | 酒精灯 |
实验2 | 2 | 4 | 水浴70℃ |
实验结果如下:
实验 | 实验现象 | ||
三颈瓶 | 收集瓶 | 试管 | |
实验1 | 酒精加入时,立刻产生白雾,当用酒精灯加热时,有气泡产生,并逐渐沸腾,生成黏稠状液体 | 有无色液体 | 溶液褪色 |
实验2 | 酒精加入时,立刻产生白雾,当用水浴加热时,不产生气泡,一段时间后,反应瓶内生成黏稠状液体 | 有无色液体 | 溶液不褪色 |
根据上述材料,完成下列填空.
(1)写出实验室用乙醇制乙烯的化学方程式: .
(2)如图装置中冷凝管的作用是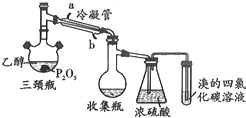
(3)实验1使溴的四氯化碳溶液褪色的物质是(写结构简式)
(4)根据实验1、2可以推断:①以P2O5作为催化剂获得乙烯的反应条件是
②P2O5与95%乙醇在水浴70℃加热条件下(三颈瓶、收集瓶中的液体经检验为磷酸三乙酯)可以发生的有机反应的类型是反应.
【答案】
(1)CH3﹣CH2﹣OH ![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
(2)冷凝导气
(3)CH2=CH2
(4)较高温度下或直接加热;酯化
【解析】解:(1)乙醇在浓硫酸、温度170℃条件下发生分子内脱水生成乙烯和水,方程式为:CH3﹣CH2﹣OH ![]() CH2=CH2↑+H2O;故答案为:CH3﹣CH2﹣OH
CH2=CH2↑+H2O;故答案为:CH3﹣CH2﹣OH ![]() CH2=CH2↑+H2O;(2)冷凝管的作用是冷凝导气; 故答案为:冷凝导气;(3)使溴的四氯化碳溶液褪色的物质是制备出来的乙烯,结构简式为CH2=CH2;
CH2=CH2↑+H2O;(2)冷凝管的作用是冷凝导气; 故答案为:冷凝导气;(3)使溴的四氯化碳溶液褪色的物质是制备出来的乙烯,结构简式为CH2=CH2;
故答案为:CH2=CH2;(4)①以P2O5作为催化剂获得乙烯的反应条件是较高温度下或直接加热;故答案为:较高温度下或直接加热;②P2O5与95%乙醇在加热条件下可以发生的有机反应的类型是酯化反应;故答案为:酯化.
(1)乙醇在浓硫酸、温度170℃条件下发生分子内脱水生成乙烯和水;(2)冷凝管的作用是冷凝导气;(3)实验制备出乙烯,乙烯能使溴的四氯化碳溶液褪色;(4)①P2O5作为催化剂获得乙烯的反应条件是较高温度下或直接加热;②联系酸与醇反应生成酯的反应的相关知识进行判断.


科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 氯气是黄绿色的,C1—是无色的
B. H2在C12中能安静燃烧,火焰呈苍白色,瓶口有白色烟雾生成
C. Cl2和H2的混合气一定会发生爆炸
D. 燃烧时一定要有氧气参加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
请回答:
(1)根据表中的实验数据,可以得到的结论是 .
(2)利用实验1中的数据,计算用KMnO4表示的化学反应速率为 .
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示.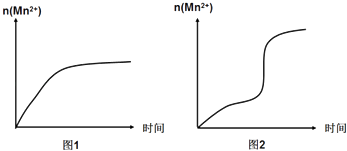
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
①该小组同学提出的假设是 .
②请你帮助该小组同学完成实验方案,并填写表中空白
实验编号 | 室温下,试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
4 | 2.0 | 2.0 | 3.0 | MnSO4 | t | |
③若该小组同学提出的假设成立,应观察到现象.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl﹣和Fe3+ .
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是>> .
(2)Na2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为 .
(3)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2 , 同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3﹣+2Cl﹣+4H+=2ClO2↑+Cl2↑+2H2O.①写出第二步反应的离子方程式 .
②工业生产时需在反应物中加少量Cl﹣ , 其作用是 .
③生产中会发生副反应ClO3﹣+Cl﹣+H+﹣Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为3/73,则起始投料时CH3OH与NaClO3的物质的量之比为 .
(4)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为﹣59℃,沸点为11.0℃,易溶于水.ClO2也可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸在60℃时反应制得.某学生用如图所示的装置模拟工业制取及收集ClO2 , 其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置.请问:①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置;
②C中应装的试剂为 . C中发生反应的化学方程式为: . 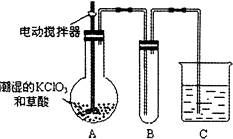
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实写出下列反应的热化学方程式.
(1)1g碳与适量水蒸气反应生成CO和H2 , 需要吸收10.94KJ热量,此反应的热化学方程式为
(2)已知2.0g燃料肼(N2H4)气体完全燃烧生成N2和水蒸气时,放出33.4KJ的热量,则肼燃烧的热化学方程式为
(3)2molAl(s)与适量O2(g)反应生成Al2O3(s),放出1669.8KJ的热量.此反应的热化学方程式为
(4)2.3g某液态有机物和一定量的氧气混合点燃,恰好完全燃烧,生成2.7g液态水和2.24LCO2(标准状况)并放出68.35KJ的热量.写出此反应的热化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com