
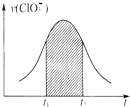
 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应V-t图.下列说法中不正确的是( )
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应V-t图.下列说法中不正确的是( )| A、反应开始时速率增大可能是c(H+)所致 |
| B、纵座标为V(H+)的V-t曲线与图中曲线完全重合 |
| C、后期反应速率下降的主要原因是反应物浓度减小 |
| D、图中阴影部分“面积”可以表示t1-t2时间为n(Cl-)增加 |


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
| A、氯气是一种重要的化工原料,可用于农药的生产等 |
| B、钠钾合金可用于快中子反应堆作热交换剂 |
| C、碳酸钠在医疗上是治疗胃酸过多的一种药剂 |
| D、镁常用来制造信号弹和焰火 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯和浓溴水用铁作催化剂制溴苯 |
| B、氯乙烷中加入AgNO3溶液检验Cl- |
| C、CH4与Cl2在光照条件下制备纯净的CH3Cl |
| D、乙烯通入Br2的CCl4溶液中制备CH2Br-CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| H+ |
| ①转化 |
2- 7 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
| A、步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42-离子浓度增大 |
| B、步骤①中当2v(CrO42-)=v(Cr2O72-)时,说明反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O达到平衡状态 |
| C、步骤②中,若要还原1mol Cr2O72-离子,需要12mol (NH4)2Fe(SO4)2?6H2O |
| D、步骤③中,当将溶液的pH调节至6 时,则可认为废水中的铬已除尽 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、③④ | C、②④⑥ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com