
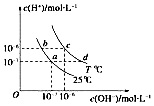
| A. | 若从a点到c点,可采用在水中加入酸的方法 | |
| B. | b点对应的醋酸中由水电离的c(H+)=10-6mol•L-1 | |
| C. | T℃时,0.05 mol•L-1的Ba(OH)2溶液的pH=11 | |
| D. | c点对应溶液的Kw大于d点对应溶液的Kw |
分析 由图象可知,c、d为T°C的曲线,Kw=10-6×10-6=10-12,a、b都为25℃时的曲线上,Kw=10-7×10-7=10-14,水的Kw只与温度有关,温度相同时Kw相同,温度升高,促进水的电离,Kw增大,T°C大于25°C,另外也可根据c(OH-)×c(H+)计算Kw大小,水的离子积只与温度有关,与溶液的类型无关,可能为纯水,也可能为酸、碱、盐溶液,
A.a、c点是温度不同的水溶液,Kw随温度变化;
B.b点对应的Kw=10-7×10-7=10-14,醋酸抑制水的电离;
C.T℃时,Kw=10-6×10-6=10-12,据此计算;
D.c、d为T°C的曲线,Kw=10-6×10-6=10-12.
解答 解:A.Kw随温度变化,若从a点到c点,需要升高温度达到,故A错误;
B.b点对应的Kw=10-7×10-7=10-14,醋酸抑制水的电离,溶液中由水电离的c(H+)<10-7mol•L-1 ,故B错误;
C.T℃时,Kw=10-6×10-6=10-12,0.05 mol•L-1的Ba(OH)2溶液中c(OH-)=0.1mol/L,溶液中氢离子浓度c(H+)=$\frac{1{0}^{-12}}{0.1}$=10-11mol/L,溶液的pH=11,故C正确;
D.c、d为T°C的曲线,温度不变离子积常数不变,图象分析可知Kw=10-6×10-6=10-12,故D错误;
故选C.
点评 本题考查了水的电离、离子积常数计算和影响因素分析,掌握基础是解题关键,题目难度不大.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:推断题
 .
. NH3•H2O
NH3•H2O  NH4++OH-.
NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学变化一定伴随着能量变化 | |
| B. | 升高温度或加入催化剂,可以改变化学反应的反应热 | |
| C. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 | |
| D. | 热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g 由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | Na2O和Na2O2中阴阳离子个数比都为1:2 | |
| C. | 18g H2O含有10NA个质子 | |
| D. | 标准状况下,11.2L H2O中含有的分子的数目为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 2,3-二乙基-1-戊烯 | D. | 3,4-二甲基-4-乙基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
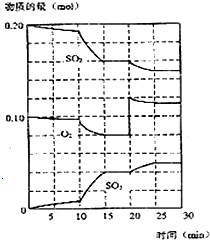 在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:2SO2(g)+O2(g)═2SO3(g)△H=-190kJ•mol-1
在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:2SO2(g)+O2(g)═2SO3(g)△H=-190kJ•mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com