
分析 ①碳酸钠是强碱弱酸盐,能发生水解生成碳酸氢钠和氢氧化钠而使溶液呈碱性;水解平衡常数等于生成物浓度系数次幂之积与反应物浓度系数次幂之积的比;
②根据水解平衡常数计算氢氧根离子的浓度,再根据水的离子积常数计算氢离子的浓度,从而计算其溶液的pH值;
③根据原子守恒和电荷守恒计算c(OH-)-c(H+)的值;
④向 Na2CO3溶液中加入明矾后,碳酸根会和铝离子发生双水解,从而生成氢氧化铝沉淀和二氧化碳气体.
解答 解:①碳酸钠是强碱弱酸盐,能发生两步水解,第一步水解生成碳酸氢根离子和氢氧根离子,水解方程式为:CO32-+H2O=HCO3-+OH-;Kh=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$,
故答案为:CO32-+H2O=HCO3-+OH-;Kh=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$,;
②Kh=2×10-4mol/L,则当溶液中c(HCO3-):c(CO32-)=2:1时,Kh=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$,=2×10-4mol/L,C(OH- )=1×10-4 mol/L,C(H+ )=1×10-10mol/L,所以溶液的pH=10,故答案为:10;
③根据原子守恒和电荷守恒计算c(OH-)-c(H+)的值,根据碳原子守恒得,c(CO32-)+c(HCO3- )+c(H2CO3)=0.1mol/L,根据溶液中电荷守恒得:2×c(CO32-)+c(HCO3- )+c(OH-)=c(Na+ )+c(H+ ),c(Na+ )=0.2mol/L,所以c(OH-)-c(H+)=c(HCO3- )+2c(H2CO3),
故答案为:c(HCO3- )+2c(H2CO3);
④向 Na2CO3溶液中加入明矾后,碳酸根会和铝离子发生双水解,从而生成氢氧化铝沉淀和二氧化碳气体,离子方程式为:3CO32-+2Al3++6H2O=2Al(OH)3↓+3CO2↑,答:反应的离子方程式为3CO32-+2Al3++6H2O=2Al(OH)3↓+3CO2↑.
点评 本题考查了化学平衡的有关问题,难度较大,难点是根据溶液中电荷守恒和原子守恒计算c(OH-)-c(H+)的值.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
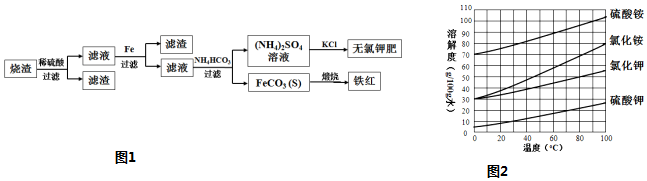
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
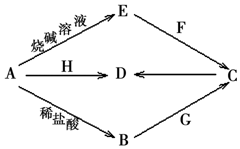 短周期元素金属单质A可发生如图所示存在转化(部分反应物、反应条件和产物已略去).F是化石燃料燃烧产生的一种温室气体;常温下,G是一种有刺激性气味的气体,其水溶液显弱碱性;H是一种具有磁性的黑色氧化物;B、C、D、E四种化合物中含有一种相同的元素.
短周期元素金属单质A可发生如图所示存在转化(部分反应物、反应条件和产物已略去).F是化石燃料燃烧产生的一种温室气体;常温下,G是一种有刺激性气味的气体,其水溶液显弱碱性;H是一种具有磁性的黑色氧化物;B、C、D、E四种化合物中含有一种相同的元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3为弱电解质 | B. | H2CO3的酸性弱于乳酸 | ||
| C. | NaHCO3也可以用来治疗胃酸过多 | D. | NaHCO3固体中含有离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径M>W>Y>Z>X | |
| B. | 1molM2W2溶于足量的水中完全反应,共转移2mol电子 | |
| C. | 由X、Y、Z、W四种元素形成的化合物一定既有离子键、又有共价键 | |
| D. | 最简单气态氢化物的稳定性:W>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO4 | |
| B. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH(aq)}{→}$Na2SiO3(aq) | |
| C. | MgCl2•6H2O $\stackrel{△}{→}$MgCl2$\stackrel{通电}{→}$Mg | |
| D. | CuSO4(aq)$\stackrel{NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{葡萄糖}$Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32克O2所含的氧原子数目为NA | |
| B. | 0.5molH2O含有的原子数目为1.5 NA | |
| C. | 1molH2O含有的H2O分子数目为NA | |
| D. | 0.5 NA个氯气分子所含氯原子的物质的量是1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,92g的NO2和N2O4混合气体所含的原子数为6NA | |
| B. | 标准状况下,将22.4LCl2通入足量的NaOH溶液中,转移的电子数为2NA | |
| C. | 1molFeCl3完全转化为Fe(OH)3胶体后生成胶粒个数为NA | |
| D. | 0.1L0.5mol/LCH3COOH溶液中的H+个数为0.05NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com