
| A. | 甲醛的电子式: | |
| B. | Cl-的结构示意图 | |
| C. | S2-核外电子排布式ls22s22p63s23p6 | |
| D. | 碳-12原子构成${\;}_{6}^{12}$C |
分析 A.甲醛分子中醛基是碳原子和氧原子形成碳氧双键;
B.氯离子的核外电子总数为18,最外层为8个电子;
C.S是16号元素,S2-核外电子数为18,根据核外电子排布规律书写核外电子排布式;
D.碳元素的质子数为6,碳-12原子的质量数为12.
解答 解:A.甲醛中存在碳氧双键,其正确的电子式为: ,故A错误;
,故A错误;
B.Cl-的质子数为17,电子数为18,离子结构示意图为: ,故B正确;
,故B正确;
C.S2-核外电子数为18,硫离子结构示意图为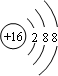 ,核外电子排布式ls22s22p63s23p6,故C正确;
,核外电子排布式ls22s22p63s23p6,故C正确;
D.碳-12原子的质子数为6,质量数为12,该碳原子可以表示为${\;}_{6}^{12}$C,故D正确;
故选A.
点评 本题考查了常见化学用语的判断,题目难度不大,注意掌握电子式、离子结构示意图、核外电子排布式、原子构成表示法等知识是解答关键,试题有利于培养学生规范答题的能力.


科目:高中化学 来源: 题型:推断题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入BaCl2溶液,有白色沉淀,则原溶液一定存在Ag+或SO42- | |
| B. | 用洁净铁丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液中有Na+ | |
| C. | 向某溶液滴加NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,可确定原溶液中无NH4+ | |
| D. | 向某溶液中加入足量的盐酸,放出二氧化碳气体,可证明该溶液中一定含有碳酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
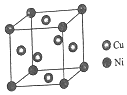
| A. | 铁的晶胞中空间利用率为74% | |
| B. | 晶胞中配位数为12的金属,一定是面心立方最密堆积 | |
| C. | Zn的晶胞类型与铜相同 | |
| D. | 简单立方堆积的晶胞中原子配位数是8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 混合物 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴的CCl4溶液 | 分液 |
| B | 溴乙烷(乙醇) | 水 | 分液 |
| C | 淀粉溶液(NaCl) | 水 | 过滤 |
| D | 皂化液(甘油) | NaCl | 盐析,分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:1 | B. | 3:2 | C. | 5:3 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O存在于所有物质中 | B. | 有的乙醇分子可能不含18O | ||
| C. | 所得酯的相对分子质量为88 | D. | 18O仅存在于乙醇和乙酸乙酯里 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据以下背景资料,回答下列问题:
根据以下背景资料,回答下列问题:| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com