
| A. | 石油的分馏、煤的干馏、电解质溶液导电均属于物理变化 | |
| B. | 做衣服的棉、麻、蚕丝的主要成分都是纤维素 | |
| C. | 鸡蛋清中加人胆矾可以使蛋白质发生聚沉.加水后重新溶解 | |
| D. | 乙烯和氯乙烯都可以通过加聚反应得到高分子化合物 |
分析 A.煤的干馏、电解质溶液导电属于化学变化;
B.蚕丝的主要成分是蛋白质;
C.胆矾属于重金属盐,与蛋白质发生变性;
D.乙烯和氯乙烯中均含有碳碳双键.
解答 解:A.煤的干馏是将煤隔绝空气加强热使煤发生复杂的化学变化的过程,电解质溶液导电有新物质生成,属于化学变化,故A错误;
B.棉、麻的主要成分是纤维素,蚕丝的主要成分是蛋白质,故B错误;
C.胆矾属于重金属盐,与蛋白质发生变性,不是盐析,故C错误;
D.乙烯和氯乙烯中均含有碳碳双键,均可以发生加聚反应生成高分子聚合物,故D正确.
故选D.
点评 本题考查了生活中常见的有机物的结构和性质,注意有机物结构与性质的关系,熟悉纤维素、蛋白质的结构和性质即可解答本题,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
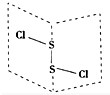 二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl,下列说法中错误的是( )
二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl,下列说法中错误的是( )| A. | S2Cl2的电子式为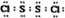 | |
| B. | 反应中SO2是还原产物,S是氧化产物 | |
| C. | S2Cl2为含有极性键和非极性键的极性分子 | |
| D. | 反应中,生成1molSO2,转移电子为3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
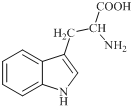 色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( )
色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( )| A. | 色氨酸的分子式为C11H12N2O2 | |
| B. | 色氨酸能发生取代、加成、酯化、中和反应 | |
| C. | 色氨酸微溶于水而易溶于酸或碱溶液是因为其与酸、碱都能反应生成盐 | |
| D. | 将色氨酸与甘氨酸(NH2CH2COOH)混合,在一定条件下最多可形成三种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
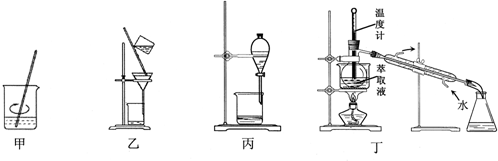
| A. | 用装置甲加稀H2SO4及H2O2氧化并用CCl4浸取 | |
| B. | 用装置乙过滤分离出浸取液 | |
| C. | 用装置丙分离得到碘的四氯化碳溶液 | |
| D. | 用装置丁分离萃取液中单质碘和四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
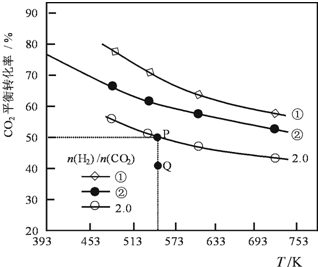 在三个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率与温度的关系如图所示.下列说法正确的是( )
在三个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率与温度的关系如图所示.下列说法正确的是( )| A. | 该反应的△H<0 | |
| B. | 氢碳比:①<② | |
| C. | 在氢碳比为2.0时,Q点v(正)<v(逆) | |
| D. | 若起始时,CO2、H2浓度分别为0.5mol•L-1和1.0mol•L-1,则可得P点对应温度的平衡常数的值为512 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染.实验小组同学欲测定空气中SO2的含量,并探究SO2的性质.
节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染.实验小组同学欲测定空气中SO2的含量,并探究SO2的性质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
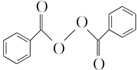 )过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图:
)过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图: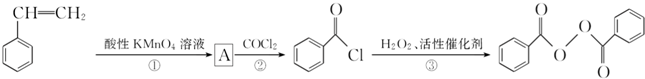
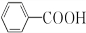 ;②的反应类型为取代反应.
;②的反应类型为取代反应.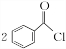 +H2O2$\stackrel{活性催化剂}{→}$
+H2O2$\stackrel{活性催化剂}{→}$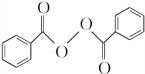 +2HCl;过氧化苯甲酰在酸性条件下水解的化学方程式为
+2HCl;过氧化苯甲酰在酸性条件下水解的化学方程式为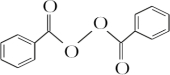 +2H2O$\stackrel{H+}{→}$
+2H2O$\stackrel{H+}{→}$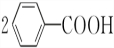 +H2O2.
+H2O2. )能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称:苯甲酸乙酯.
)能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称:苯甲酸乙酯.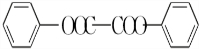 (或
(或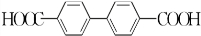 或
或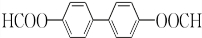 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
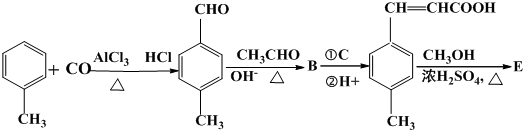
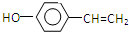 ;
;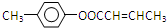 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为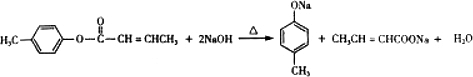 .
.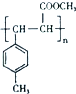 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com