
【题目】下列说法中,正确的是( )
A.1mol物质均约含有6.02×1023个分子B.6.02×1023个氢分子就是1mol H2
C.1gH2与1mol H2所含分子数相等D.1mol H2O与1molH2SO4的质量相等
【答案】B
【解析】
A.1 mol任何粒子集体都含有阿伏加德罗常数(NA)个粒子,粒子是指构成物质的基本单元,可以是原子、分子、离子、原子团、电子、质子、中子等,物质不全是由分子构成的。故1mol物质均约含有6.02×1023个分子的说法错误。A项错误;
B.根据公式![]() 可知,6.02×1023个氢分子的物质的量为1mol,B项正确;
可知,6.02×1023个氢分子的物质的量为1mol,B项正确;
C.根据![]() 的关系,可知1g H2的物质的量为
的关系,可知1g H2的物质的量为![]() ,0.5H2mol和1molH2所含分子数不相等,C项错误;
,0.5H2mol和1molH2所含分子数不相等,C项错误;
D.根据摩尔质量的定义可知,M(H2O)=18g/mol,M(H2SO4)=98g/mol,由公式![]() 可知,n相同,M不同,则m也不同,故1molH2O与1molH2SO4的质量不相等,D项错误;
可知,n相同,M不同,则m也不同,故1molH2O与1molH2SO4的质量不相等,D项错误;
答案选B。


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值)
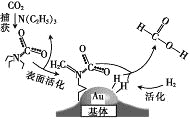
A. 标准状况下,22.4L CO2中所含的电子数目为16NA
B. 10.1g N(C2H5)3中所含的非极性共价键数目为0.3NA
C. 2mol Au与2mol H2中所含的分子数目均为2NA
D. 100g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。下列说法错误的是
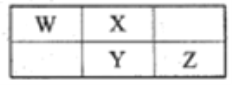
A. 单核阴离子的还原性Y强于X
B. W的气态氢化物与其最高价含氧酸反应生成离子化合物
C. X、Y、Z最简单氢化物中稳定性最弱的是Y
D. 在元素周期表中118号元素与Z位于同一主族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计能够成功的是
A.除去粗盐中含有的硫酸钙杂质
![]()
B.检验亚硫酸钠试样是否变质
![]()
C.证明酸性条件H2O2的氧化性比I2强
![]()
D.检验某溶液中是否含有 Fe2+
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期五种元素A、B、C、D、E的原子序数依次增大。A、B、C的单质在常温下都呈气态,C原子最外层电子数是电子层数的3倍,C和E位于同主族。1molDAx与足量的A2C反应生成44.8L(标准状况)G气体。A、B的单质依次为G、T,在密闭容器中充入一定量的G、T,一定条件下发生反应G+T![]() W(未配平),测得各物质的浓度如表所示。
W(未配平),测得各物质的浓度如表所示。
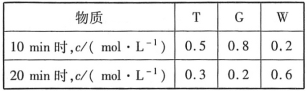
回答下列问题:
(1)A、B、C能组成既含离子键又含共价键的化合物,则该化合物的化学式为___。
(2)B、C、D、E的简单离子中,离子半径大小排序为___。(用具体的离子表示)
(3)J、L是由A、B、C、E四种元素组成的两种化合物,J、L溶液混合可产生有刺激性气味的气体,写出这两种溶液发生反应的离子方程式:___;J、L中能使酸性高锰酸钾溶液褪色的是___(填化学式)。
(4)B2A4—C2碱性燃料电池放电效率高。该电池放电时,负极反应式为___;正极附近溶液的pH___(填“增大”“减小”或“不变”)。
(5)由上述五种元素中的四种组成的单质、化合物在一定条件下的转化关系(部分条件和产物已省略)如图所示:
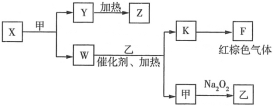
①Y是___(填化学式);W的电子式为___。
②B的最高价氧化物对应的水化物为Q,X与足量的Q溶液反应的化学方程式为___。
③1molW与足量乙完全反应生成K和甲,转移的电子数约为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假如12C相对原子质量为24,以0.024kg12C所含的12C原子数为阿伏加德罗常数(NA),则下列说法正确的是( )
A.此时CO2的摩尔质量为88gmol﹣1
B.标准状况下44gCO2体积约为11.2L
C.44gCO2与28gCO含有相同数目的原子
D.NA个O2大约为6.02×1023个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等温等压下,等质量的O2和O3所含分子个数比为________,原子个数比为________,体积之比为________。
(2)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是________(用含NA的式子表示)。
(3)配制500 mL 1 mol/L的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84 g/mL,质量分数为98%)的体积为________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用人工模拟光合作用合成甲酸的原理为2CO2+2H2O=2HCOOH+O2,装置如图所示,下列说法不正确的是( )
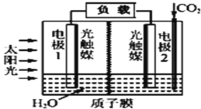
A.该装置能将太阳能转化为化学能和电能
B.电子由电极1经过负载流向电极2
C.电极2的反应式:CO2+2H++2e-=HCOOH
D.电极1周围pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程,请回答下列问题:
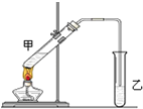
(1)浓硫酸的作用是:①__________②______________;
(2)饱和碳酸钠溶液的主要作用是________________;
(3)装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的____,长导管的作用是____;
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是____;
(5)进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是____;
(6)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是____;
(7)生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态,下列描述能说明该反应已达到化学平衡状态的是(填序号)____。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com