
(15分)用下图装置进行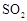 转化为
转化为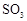 的转化率测定实验:
的转化率测定实验:

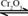
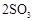 ;
;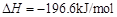 。已知:
。已知:
|
|
熔点( |
沸点( |
|
|
-72.4 |
-10 |
|
|
16.8 |
44.3 |
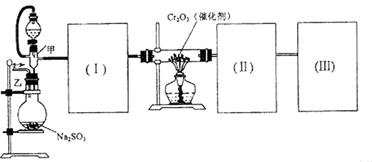
(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接合适的装置(可重复使用),请从下列A~E中选择适宜的装置,将其序号填入空格内。

(2)将装置连接好,实验前,必须进行的操作是(不必写具体过程) 。
(3)实验时,浓硫酸能顺利滴入烧瓶中,甲装置所起的作用是 。
(4)开始实验时,先从乙处均匀通入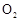 ,为使
,为使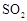 有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是
。
有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是
。
(5)实验中“当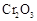 表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是
;若用大火加热有
表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是
;若用大火加热有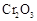 处的反应管时,
处的反应管时,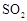 的转化率会
(填“升高”、“降低”或“不变”)。
的转化率会
(填“升高”、“降低”或“不变”)。
(6)实验时若用25.2g的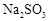 ,加入的浓硫酸是足量的,反应结束时继续通入
,加入的浓硫酸是足量的,反应结束时继续通入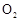 一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中
一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中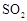 的转化率为
%(保留小数点后一位)。
的转化率为
%(保留小数点后一位)。
(1)`Ⅰ:B Ⅱ:A Ⅲ:BE(各1分,共3分)
(2)检查装置的气密性(2分)
(3)保持分液漏斗内压强与烧瓶内压强相等(2分)
(4)先加热催化剂,然后缓慢滴加浓硫酸(2分)
(5)温度过高不利于SO3的生成,且影响催化剂的活性(2分) 降低(2分)
(6)70.6%(2分)
【解析】综合题给信息,实验装置自左至右分别为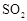 的发生装置生成
的发生装置生成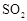 ,经浓硫酸干燥(I)后催化氧化,生成的SO3的经冰水冷凝(II)在U型管中,为了避免SO3吸水及SO2污染空气,在(III)中填加浓硫酸的吸水装置及NaOH的尾气吸收装置。
,经浓硫酸干燥(I)后催化氧化,生成的SO3的经冰水冷凝(II)在U型管中,为了避免SO3吸水及SO2污染空气,在(III)中填加浓硫酸的吸水装置及NaOH的尾气吸收装置。
(4)为防止SO2的损失应该先预热催化剂,然后缓慢滴加浓硫酸
(5)2SO2+O2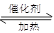 2SO3,正反应是放热反应,温度过高不利于SO3的生成,且影响催化剂的活性。
2SO3,正反应是放热反应,温度过高不利于SO3的生成,且影响催化剂的活性。
(6)Na2SO3 → SO2 → SO3
可: 25.2g 16g
故:SO2的转化率为:11.3/16 = 70.6%


科目:高中化学 来源: 题型:
(15分)现用下图所示装置及所给药品探究工业制硫酸时二氧化硫的转化率。已知C中含硫酸n mol,设气体进入C和D时能分别完全吸收某一种气体,且忽略装置内空气中的CO2。
请回答下列问题:
(1)检查完装置的气密性且加入药品后,开始进行时首先应进行的操作是
。
(2)通过观察中气泡的逸出速率可控制SO2和O2的流量和体积比,A装置还起的作用有 。
(3)为了提高测定SO2转化率的准确度,下列操作或改进可行的是(填序号) 。
①熄灭酒精灯后,停止通入SO2,继续通入O2一段时间
②熄灭酒精灯后,停止通入O2,继续通入SO2一段时间
③在C、D之间加装一个盛有浓硫酸的洗气瓶
(4)若气体经过充分,实验结束后,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为w g。若装置D增加的质量为a g,则二氧化硫的转化率是:
(用含字母的代数式表示,结果可不化简)。
(5)若向接触室中通入2 molSO2(g)和1molO2(g),在一定温度下,反应达到平衡时测得接触室内的压强为起始时的0.75倍,则SO2的转化率为 ;相同条件下,当起始时同时通入a mol SO2、bmol O2、c mol SO3(g)时,达到平衡时与原平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省瑞安中学高二下学期期末化学试卷(带解析) 题型:实验题
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等。过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量。
(1)某研究小组拟用下图装置测定一定质量的样品中过氧化镁的含量。
①实验前需进行的操作是 ,稀盐酸中加入少量FeCl3溶液的作用是 。
②用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下; 。
③实验终了时,待恢复至室温,先 ,再平视刻度线读数。
(2)实验室还可通过下列两种方案测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
已知常温下Ksp[Mg(OH)2]=l×10-11。为使方案I中Mg2+完全沉淀[即溶液中c(Mg2+)≤l ×10-5mol/L],溶液的pH至少应调至 。
方案Ⅱ:用电子天平称取0.1000g样品置于锥形瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,加入少量 作指示剂;然后用 式滴定管盛装0. 1000 mol/L Na2S2O3溶液进行滴定. (已知:I2+2Na2S2O3= Na2S4O6+2NaI)
查看答案和解析>>
科目:高中化学 来源:2010年西藏拉萨中学高三下学期第七次月考(理综)化学部分 题型:实验题
(15分)现用下图所示装置及所给药品探究工业制硫酸时二氧化硫的转化率。已知C中含硫酸nmol,设气体进入C和D时能分别完全吸收某一种气体,且忽略装置内空气中的CO2。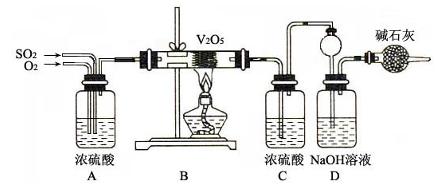
请回答下列问题:
(1)检查完装置的气密性且加入药品后,开始进行时首先应进行的操作是
。
(2)通过观察中气泡的逸出速率可控制SO2和O2的流量和体积比,A装置还起的作用有 。
(3)为了提高测定SO2转化率的准确度,下列操作或改进可行的是(填序号) 。
①熄灭酒精灯后,停止通入SO2,继续通入O2一段时间
②熄灭酒精灯后,停止通入O2,继续通入SO2一段时间
③在C、D之间加装一个盛有浓硫酸的洗气瓶
(4)若气体经过充分,实验结束后,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为w g。若装置D增加的质量为a g,则二氧化硫的转化率是:
(用含字母的代数式表示,结果可不化简)。
(5)若向接触室中通入2 molSO2(g)和1molO2(g),在一定温度下,反应达到平衡时测得接触室内的压强为起始时的0.75倍,则SO2的转化率为 ;相同条件下,当起始时同时通入a mol SO2、b mol O2、c mol SO3(g)时,达到平衡时与原平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
查看答案和解析>>
科目:高中化学 来源:2012届河北省保定市高三上学期期末调研考试理科综合化学试卷(解析版) 题型:实验题
(15分)通过测量一定质量的Fe、Al合金与M的溶液反应生成H2在标准状况下的体积,可以计算出合金中Fe、Al的旗量分数,若用下图装置来制取H2,请完成下列操作步骤直至产生H2。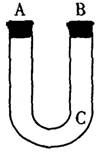
(1)C处塞入玻璃丝绒团;
(2) A处 ___________________________
(3) B处_____________________________
(4) ____________________________________
(5) ____________________________________;
(6) 在分液櫬斗中加入M的溶液。
(7) ______________________________________________________
查看答案和解析>>
科目:高中化学 来源:2010年西藏拉萨中学高三下学期第七次月考(理综)化学部分 题型:实验题
(15分)现用下图所示装置及所给药品探究工业制硫酸时二氧化硫的转化率。已知C中含硫酸n mol,设气体进入C和D时能分别完全吸收某一种气体,且忽略装置内空气中的CO2。

请回答下列问题:
(1)检查完装置的气密性且加入药品后,开始进行时首先应进行的操作是
。
(2)通过观察中气泡的逸出速率可控制SO2和O2的流量和体积比,A装置还起的作用有 。
(3)为了提高测定SO2转化率的准确度,下列操作或改进可行的是(填序号) 。
①熄灭酒精灯后,停止通入SO2,继续通入O2一段时间
②熄灭酒精灯后,停止通入O2,继续通入SO2一段时间
③在C、D之间加装一个盛有浓硫酸的洗气瓶
(4)若气体经过充分,实验结束后,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为w g。若装置D增加的质量为a g,则二氧化硫的转化率是:
(用含字母的代数式表示,结果可不化简)。
(5)若向接触室中通入2 molSO2(g)和1molO2(g),在一定温度下,反应达到平衡时测得接触室内的压强为起始时的0.75倍,则SO2的转化率为 ;相同条件下,当起始时同时通入a mol SO2、b mol O2、c mol SO3(g)时,达到平衡时与原平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com