
| A、H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ?mol-1 | ||
| B、CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3 kJ?mol-1 | ||
| C、2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ?mol-1 | ||
D、CO(g)+
|


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 (1)已知298K时,1mol C2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1 558.3kJ.写出该反应的热化学方程式:
(1)已知298K时,1mol C2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1 558.3kJ.写出该反应的热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液肯定显碱性 |
| B、该溶液肯定显酸性 |
| C、该溶液的pH可能是11,也可能是3 |
| D、该溶液的pH肯定不是11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1个金属原子失去电子的多少 |
| B、1摩金属失去电子的多少 |
| C、原子失去电子能力的大小 |
| D、1摩金属与水反应放出H2的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、V(H2)=0.1 mol?Lˉ1?minˉ1 |
| B、V(N2)=0.1 mol?Lˉ1?minˉ1 |
| C、V(NH3)=0.15 mol?Lˉ1?minˉ1 |
| D、V(N2)=0.002 mol?Lˉ1?sˉ1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解熔融CeO2制Ce,铈在阳极获得 | ||||||||
| B、铈溶于氢碘酸的化学方程式可表示为:Ce+4HI═CeI4+2H2↑ | ||||||||
| C、用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ | ||||||||
D、四种稳定的核素
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
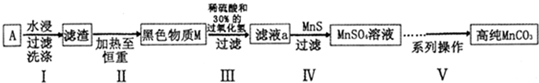
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com