
分析 (1)铜和稀硝酸反应生成硝酸铜、NO和水;NO气体难溶于水和空气中氧气易发生反应;
(2)实验室制备氨气是利用氢氧化钙和氯化铵固体加热反应得到,氨气和二氧化氮反应生成氮气和水;
(3)将盛有NO2的试管倒扣水中,NO2能和水发生反应:3NO2+H2O=2HNO3+NO,所剩余气体的体积的体积为原来气体体积的$\frac{1}{3}$,生成硝酸为原来的$\frac{2}{3}$,溶液体积为$\frac{2}{3}$,根据生成的硝酸的物质的量和所得溶液的体积来计算硝酸的浓度;
(4)铜与稀硫酸不反应,加入某种物质后能溶解,说明所加物质在酸性条件下具有强氧化性,可与铜发生氧化还原反应生成可溶性铜盐,以此解答即可.
解答 解:(1)铜和稀硝酸反应生成硝酸铜、NO和水,离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,NO气体难溶于水和空气中氧气易发生反应,不能用排空气方法收集,只能用排水取气法收集,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;排水集气;
(2)实验室用氢氧化钙与氯化铵加热反应制取氨气,化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,用NH3处理NO2可使之转化为对大气无污染的产物,该反应的化学方程式为:8NH3+6NO2=7N2+12H2O
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O; 8NH3+6NO2=7N2+12H2O;
(3)将盛有NO2的试管倒扣水中,NO2能和水发生反应:3NO2+H2O=2HNO3+NO,则有:
3NO2 +H2O=2HNO3 +NO
3,2 1
设二氧化氮体积为3L,则生成硝酸物质的量=$\frac{2L}{22.4L/mol}$,得到硝酸溶液体积2L,则试管中溶液的物质的量浓度=$\frac{\frac{2L}{22.4L/mol}}{2L}$=0.045mol/L,故答案为:0.045mol/L;
(4)铜片不溶于非氧化性酸中,但稀硫酸中加入硝酸钾后,溶液中存在H+和NO3-,相当于稀硝酸,铜片能溶于稀硝酸中,发生发生反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,①浓H2SO4,铜和浓硫酸加热反应,加入不能溶解铜,
②H2O2 加入后会发生反应 Cu+H2SO4+H2O2=CuSO4+2H2O,铜溶解,
③BaCl2 加入不能溶解铜,
④KNO3 加入形成稀硝酸能溶解铜,发生发生反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
⑤FeCl3具有氧化性能溶解铜,发生反应2Fe3++Cu=2Fe2++Cu2+,
故答案为:②④⑤.
点评 本题考查了氧化还原反应、定量计算、离子方程式和化学方程式书写等知识点,掌握基础是解题关键,题目难度中等.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
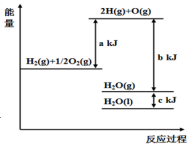
| A. | 1 mol H2(g)与$\frac{1}{2}$ mol O2(g)所具有的总能量比1 mol H2O(g)所具有的总能量高 | |
| B. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 | |
| C. | 2 mol H(g)与1 mol O(g)生成1 molH2O(g)所放出的热量是b kJ | |
| D. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=2(b+c-a)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
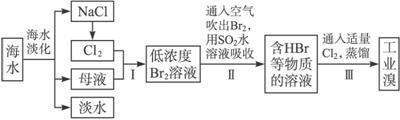
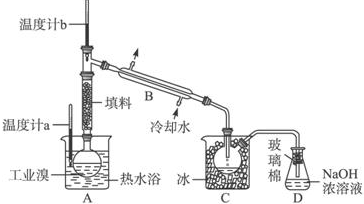
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数为2的元素一定处于周期表IIA族 | |
| B. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | |
| C. | 某元素原子核外的电子数为63,则它是第6周期副族元素 | |
| D. | 除短周期外,其他周期均为18种元素,副族元素没有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
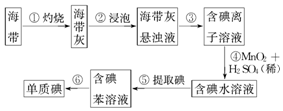
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
. .
.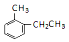 的名称是2-甲基乙苯.
的名称是2-甲基乙苯. +CH3COOH$?_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. 的一种同分异构体的结构简式
的一种同分异构体的结构简式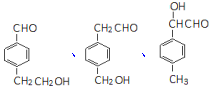 任一种.
任一种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com