
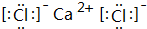 .
. ;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8电子的稳定结构,该分子的结构式为S=C=S.
;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8电子的稳定结构,该分子的结构式为S=C=S.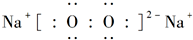 (填电子式),其化学键类型为离子键、非极性共价键(填“离子键”、“非极性共价键”、“极性共价键”中的一种或多种).
(填电子式),其化学键类型为离子键、非极性共价键(填“离子键”、“非极性共价键”、“极性共价键”中的一种或多种). 分析 (1)融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为$\frac{54}{3}$=18,则为Ca2+、Cl-,故XY2是CaCl2,X为Ca,Y为Cl;
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为硫元素;E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成的类似于CO2的三原子分子为CS2,与二氧化碳结构类似,属于共价化合物;
(3)W是与S同主族的短周期元素,则W为O元素,Z是第三周期金属性最强的元素,则Z为Na,钠与氧气不加热时生成Na2O,钠与氧气在加热条件下反应生成Na2O2.
解答 解:(1)融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为$\frac{54}{3}$=18,则为Ca2+、Cl-,故XY2是CaCl2,X为Ca,Y为Cl,CaCl2的电子式为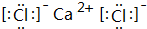 ,
,
故答案为:CaCl2;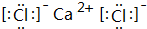 ;
;
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为硫元素,S2-离子结构示意图是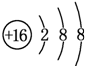 ;
;
E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成的类似于CO2的三原子分子为CS2,与二氧化碳结构类似,其结构式为:S=C=S,
故答案为: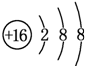 ;S=C=S;
;S=C=S;
(3)W是与S同主族的短周期元素,则W为O元素,Z是第三周期金属性最强的元素,则Z为Na,钠与氧气不加热时生成Na2O,钠与氧气在加热条件下反应生成Na2O2,其电子式为: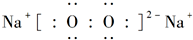 ,含有离子键、非极性共价键,
,含有离子键、非极性共价键,
故答案为:Na2O;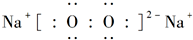 ;离子键、非极性共价键.
;离子键、非极性共价键.
点评 本题考查结构性质位置关系、常用化学用语、物质结构与性质等,难度不大,侧重对常用化学用语的考查,注意对基础知识的理解掌握.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
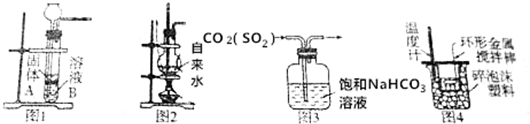
| A. | 用图1装置,若A为石灰石,B为稀硫酸,则可制取二氧化碳 | |
| B. | 用图2装置,若加上冷凝装置,可制取蒸馏水 | |
| C. | 用图3装置,可除去二氧化碳中的杂质二氧化硫 | |
| D. | 用图4装置,可测定中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁在干燥的环境中不易腐蚀 | |
| B. | 原电池工作时,电解质溶液中的阳离子移向正极 | |
| C. | 用铝质铆钉铆接铁板,铆接处的铁板更易被腐蚀 | |
| D. | 集中回收处理废旧电池的主要目的是防止电池中的重金属离子污染土壤和水源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素在自然界均不能以游离态存在 | |
| B. | X、Z、W均可形成两种常见氧化物 | |
| C. | 元素X、Y、W的最高化合价均与其族序数相等 | |
| D. | 离子半径:W>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可在金属与非金属交界处寻找半导体材料 | |
| B. | 农药中常含有的元素通常在元素周期表的右上方区域内 | |
| C. | 作催化剂材料的元素通常在元素周期表的左下方区域内 | |
| D. | 在过渡元素中可寻找耐高温和耐腐蚀的合金材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Fe2+ | |
| B. | 滤纸上有Ag、Cu,滤液中有Ag+、Zn2+、Fe2+ | |
| C. | 滤纸上有Ag、Cu、Fe,滤液中有Cu2+、Zn2+、Fe2+ | |
| D. | 纸上有Ag、Cu、Fe、Zn,滤液中有Zn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com