
【题目】下列关于化学变化的叙述错误的是
A. 化学变化一定伴随能量变化
B. 化学变化一定有化学键的断裂和生成
C. 化学变化一定伴随物质的状态变化
D. 化学变化一定有新物质生成
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下
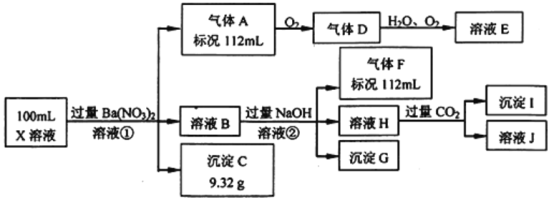
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的离子分别是________。
(2)若②中所用氢氧化钠浓度为2 mol/L,当加入10 mL时开始产生沉淀,55 mL时沉淀的量达到最大值0.03 mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60 mL时沉淀的量降为0.025 mol且保持不变,则原溶液中:c(Fe2+)为_____mol/L、c(Fe3+)为______mol/L、c(Cl-)为_____mol/L。(若有些离子不存在,请填0 mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是
A. 检验试液中的SO42-![]()
B. 检验试液中的Fe2+![]()
C. 检验试液中的I-![]()
D. 检验试液中的CO32-![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1)氨水是中学常见碱
①下列事实可证明氨水是弱碱的是________(填字母序号)。
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0.1mol/L氨水pH为11
C.铵盐受热易分解
D.常温下,0 1mol/L氯化铵溶液的pH为5
②下列方法中,可以使氨水电离程度增大的是______(填学母序号)。
A.通入氨气 B.如入少量氯化铁固体
C.加水稀释 D.加入少量氯化铵固体
(2)25℃,在0.1mol/L H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,密液pH与c(S2-
关系如下图(忽略溶液体积的变化、H2S的挥发)。
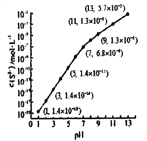
①pH=13 时,溶液中的c(H2S)+c(HS-)=______mol/L。
②某溶液含0.020mol/LMn2+、0.10mol/LH2S,当溶液pH=____时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)聚合硫酸铁(PFS) 是水处理中重要的絮凝剂。盐基度B是衡量絮凝剂紫凝效果的重要指标,定义式为B=3n(OH-)/n(Fg3+)(n为物质的量)。为测量样品的B值。取样品mg,准确加入过量盐酸,充分反应,再加入点沸后冷却的蒸馏水,以酚酞为指示剂,用cmol/L的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液VmL。按照上述步骤做空白对照试验,消耗NaOH溶液V0mL已知该样品中Fe的质量分数w,则B 的表达式为_________。
(4)常温时,若Ca(OH)2和CaWO4 (钨酸钙) 的沉淀溶解平衡曲线如图所示(已知: ![]() =0.58)。
=0.58)。
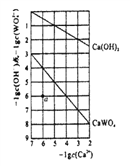
①a点表示Ca(OH)2和CaWO4________(填“是”或“否”)达到溶解平衡,说 明理由_______________。
②饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合,写出混合溶液中各离了浓度大小关系__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1molL-1NaHCO3溶液的pH=8.31,有关该溶液的判断正确的是
A. c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
B. Ka1(H2CO3)Ka2(H2CO3)<KW
C. c(H+)+c(Na+)=c(OH-)+c(HCO3-)+c(CO32-)
D. 加入适量NaOH溶液后:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-11。某溶液中含有Cl-,Br-,CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A. Cl-、Br-、CrO42- B. CrO42-、Br-、Cl-、
C. Br-、Cl-、CrO42- D. Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A. 28g乙烯和丙烯中的极性键数目为4NA
B. 32gCu和32gS充分反应,转移电子数为NA
C. 1L0.3mol·L-1Na2CO3溶液中的阴离子数目小于0.3NA
D. 0.2molNH3与0.3molO2在催化剂的作用下充分反应,所得NO的分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池、电解池的叙述中正确的是
A. 发生氧化反应的电极分别为负极和阴极
B. 阴离子分别向负极和阴极迁移
C. 电子流向分别由负极直接流向正极、阴极直接流向阳极
D. 若都有一个电极质量减轻,应分别为负极和阳极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com