
| A.第3周期所含元素中钠的第一电离能最小 |
| B.铝的第一电离能比镁的第一电离能大 |
| C.在所有的元素中,F的第一电离能最大 |
| D.钾的第一电离能比镁的第一电离能大 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
| A.正丁烷和异丁烷 | B.红磷和白磷 | C.氕和氚 | D.氯气和液氯E.冰和干冰 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第9列中元素中没有非金属元素 |
| B.只有第二列的元素原子最外层电子排布为ns2 |
| C.第四周期第9列元素是铁元素 |
| D.第10、11列为ds区 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电负性用来描述不同元素的原子对键合电子吸引力的大小 |
| B.电负性是以氟为4.0、锂为1.0作为标准的相对值 |
| C.元素电负性越小,元素金属性越强 |
| D.元素电负性越大,元素非金属性越强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
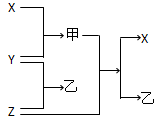
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
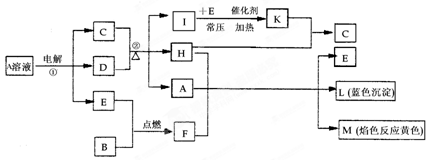
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
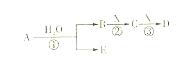
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com