
【题目】为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的 (不必选其他酸性物质)。请据此回答:
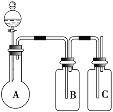
(1)圆底烧瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为______________。
(2)装置B所盛的试剂是_________________,其作用是__________________________。
(3)装置C所盛试剂是___________________,C中反应的离子方程式是_____________________________。
(4)由此可得出的结论是:酸性:__________________>_________________>_____________________。
【答案】盐酸 饱和NaHCO3溶液 吸收HCl气体 Na2SiO3溶液 CO2+SiO32-+H2O=CO32-+H2SiO3↓ HCl H2CO3 H2SiO3
【解析】
根据较强酸制取较弱酸可知,较强酸能和较弱酸盐反应生成较弱酸,较弱酸能制取更弱的酸,要想验证HCl、H2CO3、H2SiO3的酸性强弱,用盐酸和碳酸盐反应制取二氧化碳,用二氧化碳和硅酸钠溶液制取硅酸,根据实验现象确定酸的相对强弱,据此分析解答。
(1)用盐酸和碳酸盐反应制取二氧化碳,用二氧化碳和硅酸钠溶液制取硅酸,因此分液漏斗中的试剂为盐酸;
(2)盐酸有挥发性,导致二氧化碳气体中含有HCl,会对实验造成干扰,所以B装置要盛放能除去HCl,且不能产生新的杂质、不能和二氧化碳反应的药品,一般常用饱和碳酸氢钠溶液,作用是除去二氧化碳中混有的HCl;
(3)根据以上分析可知C为硅酸钠溶液,二氧化碳和硅酸钠溶液反应生成碳酸钠和硅酸沉淀,反应的离子方程式为CO2+SiO32-+H2O=CO32-+H2SiO3↓。
(4)根据较强酸制备较弱酸可知得出的结论是酸性HCl>H2CO3>H2SiO3。


 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:
【题目】工业上用丁烷催化脱氢侧备丁烯:C4H10(g)![]() CH4(g)+H2(g)(正反应吸热)。将丁烷和氢气以一定的配比通过填充有催化剂的反应器(氢气的作用是活化催化剂),反应的平衡转化率、产率与温度、投料比有关。下列判断不正确的是
CH4(g)+H2(g)(正反应吸热)。将丁烷和氢气以一定的配比通过填充有催化剂的反应器(氢气的作用是活化催化剂),反应的平衡转化率、产率与温度、投料比有关。下列判断不正确的是
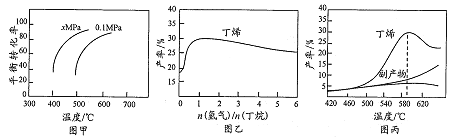
A. 由图甲可知,x小于0.1
B. 由图乙可知,丁烯产率先增大后减小,减小的原因是氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速 率减小
C. 由图丙可知产率在590℃之前随温度升高面增大的原因可能是溫度升高平衡正向移动
D. 由图丙可知,丁烯产率在590℃之后快速降低的主要原因为丁烯高温分解生成副产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:_____H2O2 +___Cr2(SO4)3 +_______KOH=________K2CrO4 +________K2SO4 +_______H2O
(1)配平该方程式,并用单线桥法表示电子转移情况。
(2)此反应中氧化剂是__________。
(3)若消耗1molL-1Cr2(SO4)3溶液的体积为50mL,则转移电子的物质的量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是( )
A.过滤操作时,用玻璃棒搅拌漏斗内的液体,以加速过滤
B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,可以选用酒精作为萃取剂从碘水中萃取碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T℃时,向V L的密闭容器中充入一定量的A和B,发生的反应为A(g)+B(g)![]() C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是

A. 前10 min的平均反应速率v(D)=0.3 mol·L-1·min-1
B. 该反应的平衡常数表达式为K=c(C)c2(D)/[c(A)c(B)]
C. 若达到平衡时保持温度不变,压缩容器体积,平衡不移动
D. 反应至15 min时,改变的条件可以是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验现象及其解释不正确的是
A. 金属钠在Cl2中燃烧产生白烟,这是因为产生的NaCl固体颗粒分散到空气中所致
B. 把烧红的铁丝放在氧气中,发出耀眼白光,产生黑色固体,这是因为该反应放热多,生成的Fe3O4为黑色
C. 单质Mg、Al与O2反应,条件不同,可能产生不同的产物
D. 镁带在空气中点燃发出耀眼光芒,并发生三个反应:2Mg+O2![]() 2MgO、3Mg+N2
2MgO、3Mg+N2![]() Mg3N2、2Mg+CO2
Mg3N2、2Mg+CO2![]() 2MgO+C(黑色),Mg常用于照明弹。在这些反应中,Mg都是作还原剂
2MgO+C(黑色),Mg常用于照明弹。在这些反应中,Mg都是作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:
3Fe2++2S2O![]() +O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是( )
+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A. O2和S2O![]() 是氧化剂,Fe2+是还原剂
是氧化剂,Fe2+是还原剂
B. 每生成1mol Fe3O4,则转移电子数为2mol
C. 参加反应的氧化剂与还原剂的物质的量之比为1﹕1
D. 若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com