
| A. | 原子半径:W>Y | B. | 最高价含氧酸酸性:W>R | ||
| C. | 气态氢化物稳定性:Y>R | D. | 简单离子半径:Y>Z |
分析 X、Y、Z、W、R均为短周期主族元素,原子序数依次增加,Z在短周期元素中金属性最强,则Z为Na;W元素原子的次外层电子数为最外层电子数的2倍,W为Si元素;R的原子序数是Y的2倍,Y与R同主族,则Y为O,R为S;X与W同主族可知X为C,然后结合元素周期律来解答.
解答 解:X、Y、Z、W、R均为短周期主族元素,原子序数依次增加,Z在短周期元素中金属性最强,则Z为Na;W元素原子的次外层电子数为最外层电子数的2倍,W为Si元素;R的原子序数是Y的2倍,Y与R同主族,则Y为O,R为S;X与W同主族可知X为C,
A.电子层越多,原子半径越大,原子半径:W(Si)>Y(O),故A正确;
C.非金属性R>W,最高价含氧酸酸性为R>W,故B错误;
C.非金属性Y>R,气态氢化物稳定性:Y>R,故C正确;
D.具有相同电子排布的离子原子序数大的离子半径小,则简单离子半径:Y>Z,故D正确;
故选B.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
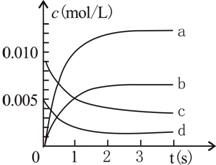 800℃时,在2L密闭容器内加入N0和02,发生反应:2N0(g)+O2(g)?2N02(g),测得n(N0)随时间的变化如表,请回答:
800℃时,在2L密闭容器内加入N0和02,发生反应:2N0(g)+O2(g)?2N02(g),测得n(N0)随时间的变化如表,请回答:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
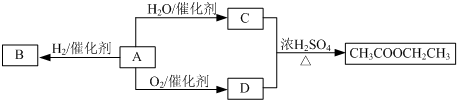
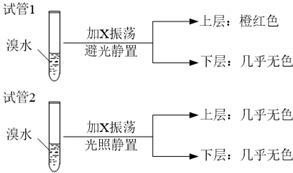
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| B. | 步骤Ⅱ中质量减少的物质一定是Cu | |
| C. | 根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2 | |
| D. | 根据步骤Ⅱ可以得出,m(Fe2O3):m(Cu)=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
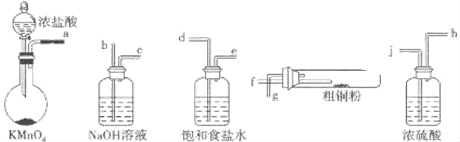
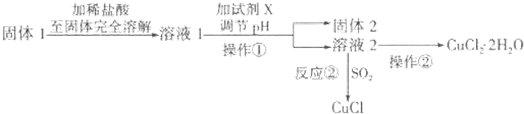
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
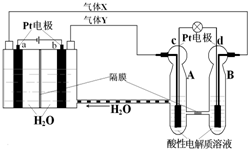 RFC是一种将水电解技术与氢氧燃料电池技术相互结合的可充电电池,RFC工作原理如图所示.则下列有关说法正确的是( )
RFC是一种将水电解技术与氢氧燃料电池技术相互结合的可充电电池,RFC工作原理如图所示.则下列有关说法正确的是( )| A. | c电极发生还原反应,B池中H+通过隔膜进入A池 | |
| B. | b电极上发生的电极反应是:2H2O+2e-═H2↑+2OH- | |
| C. | 转移0.1mol电子时,a电极产生标准状况O21.12L | |
| D. | d电极上发生的电极反应是:O2+4H++4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
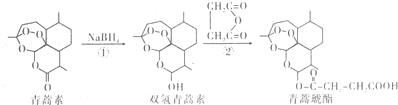
| A. | 青蒿素分子中所有碳原子在同一平面内 | |
| B. | 反应①属于还原反应,反应②理论上原子利用率可达100% | |
| C. | 双氢青蒿素属于芳香化合物 | |
| D. | 青蒿琥酯可以发生水解、酯化以及加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=0.1时,发生的反应为2I-+Br2═I2+2Br- | |
| B. | 当a=0.25时,发生的反应为2Fe2++4I-+3Br2═2Fe3++2I2+6Br- | |
| C. | 当溶液中I-有一半被氧化时,c(I-):c(Br-)=1:1 | |
| D. | 当0.2<a<0.3时,溶液中各离子浓度的关系为2c(Fe2+)+3c(Fe3+)+c(H+)═c(Br-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应水化物的碱性大小顺序一定是:X>Y | |
| B. | 离子半径和原子半径由大到小的顺序均为X>Y>Z>W | |
| C. | 氢化物的稳定性是Z>W;氢化物的沸点是Z<W | |
| D. | 还原性Zm->W(m+1)-,氧化性Xn+>Y(n+1)+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com