
| A. | 乙醇可由淀粉、纤维素等在一定条件下制得 | |
| B. | 乙醇、乙酸生成乙酸乙酯的反应属于取代反应 | |
| C. | 乙醇可与NaOH稀溶液反应 | |
| D. | 乙醇与二甲醚(CH3 OCH3)是同分异构体 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间 物质 | 0 min | 10 min | 30 min | 60 min | 70 min |
| CO2(mol/L) | 0 | 0.2 | 0.6 | 0.8 | 0.8 |
| CH3OH(mol/L) | 1.0 | 0.8 | 0.4 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素X、Y、Z、W在周期表中的相对位置如图,X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐.下列判断错误的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐.下列判断错误的是( )| A. | 最简单气态氢化物的稳定性:X>Y | |
| B. | 单核阴离子半径:Z>W | |
| C. | 含Z元素的盐溶液可能显酸性、碱性或中性 | |
| D. | W元素的单质具有漂白性,常用于自来水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 一段时间后Zn电极逐渐溶解 | |
| B. | 该装置中Cu极为正极,发生还原反应 | |
| C. | b极反应的电极反应式为:H2-2e-=2H+ | |
| D. | 电流方向:a电极→ →Cu电极 →Cu电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
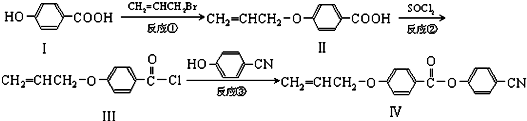
 .
. 也可与III发生类似反应③的反应,生成有机物V,V的结构简式是
也可与III发生类似反应③的反应,生成有机物V,V的结构简式是 .
.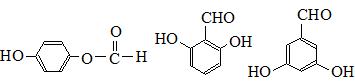 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com