
| 5.6L |
| 22.4l/mol |
|


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓SO42- |
| B、H2SO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++=BaSO4↓+H2O |
| C、铜片插入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag |
| D、澄清石灰水中加入盐酸 Ca(OH)2+2H+=Ca2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A占的体积比B大 |
| B、A的物质的量比B大 |
| C、A的密度比B小 |
| D、A的摩尔质量比B大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
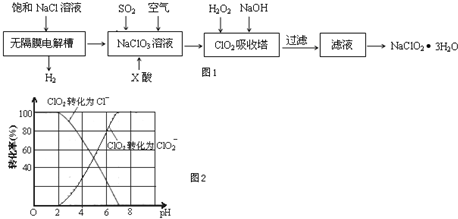
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2 | B、2:3 |
| C、3:1 | D、5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述三个反应都有单质生成,所以都是置换反应 |
| B、氧化性由强到弱顺序为KClO3>KBrO3>Cl2>Br2 |
| C、反应②中还原剂与氧化剂的物质的量之比为5:1 |
| D、③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com