
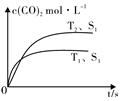
 一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:| 0.01mol•L-1 的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
分析 (1)平衡常数K350℃<K300℃,说明温度升高时平衡逆向移动,△H-T△S<0时,反应能够自发进行;
(2)A、扩大容器体积,平衡逆向移动,但各组分浓度都减小;
B、恒温恒容下,再充入2molNO2和1molO2,相当于加压,平衡正向移动;
C、容器体积不变,气体质量不变;
D、正反应放热,降温平衡正向移动;
(3)应用盖斯定律解题,接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同;
(4)①部分电离的电解质是弱电解质,如果亚硝酸部分电离则亚硝酸是弱电解质,可以根据酸溶液或钠盐溶液的pH判断;
②所给微粒中既能结合H+又能提供H+的有H2PO4-、H2O和H2N-CH2COOH,因此这四种物质从酸碱质子理论的角度上看既是酸又是碱,即两性物质;
③若向Na2HPO4溶液中加入足量的CaCl2溶液,HPO42-离子和Ca2+离子反应生成沉淀,促进HPO42-的电离,溶液显示酸性;
(5)X、Y、Z各1mol•L-1同时溶于水中制得混合溶液,溶液中的溶质为等物质的量浓度的硝酸钠和亚硝酸钠,亚硝酸钠能水解而使溶液呈碱性,则c(OH-)>c(H+),钠离子和硝酸根离子都不水解,但盐类水解较微弱,所以离子浓度大小关系是c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+);
解答 解:(1)温度升高时平衡逆向移动,说明正反应放热;该反应的正反应放热,则逆反应吸热,△H>0,若逆反应能够自发进行,则其,△H-T△S<0,必须要△S>0,故答案为:放热;逆反应方向的△S>0;
(2)A、扩大容器体积,无论平衡怎样移动,各组分浓度都减小,混合气体颜色变浅,故A错误;
B、与开始加入比例相同加入反应物,平衡正向移动,反应物转化率增大,故B正确;
C、容器中气体密度始终不变,所以密度不变不能说明反应达到平衡状态,故C错误;
D、降温平衡正向移动,化学平衡常数增大,故D正确;
故答案为:BD;
(3)由①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②CO(g)+1/2O2(g)=CO2 (g)△H=-283kJ•mol-1
2×②-①得:2NO(g)+2CO(g)=N2(g)+2CO2(g))△H=-746.5kJ•mol-1,
接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T2到达平衡时相同,故c(CO2)在T2、S2条件下达到平衡过程中的变化曲线为: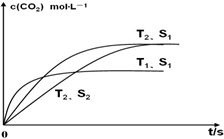 ,
,
故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g))△H=-746.5kJ•mol-1; ;
;
(4)①A、亚硝酸钠溶液的pH>7,说明亚硝酸钠是强碱弱酸盐,其溶液呈碱性,所以能证明亚硝酸是弱酸,故A正确;
B、亚硝酸能与氢氧化钠发生中和反应只能说明亚硝酸具有酸性,不能说明亚硝酸的电离程度,所以不能证明亚硝酸是弱酸,故B错误;
C、用亚硝酸钠溶液作导电实验,灯泡很暗,不能说明亚硝酸的电离程度,所以不能证明亚硝酸是弱酸,故C错误;
D、常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4,说明稀释亚硝酸时,其氢离子物质的量增大,存在电离平衡,故D正确;
E.NaNO2和H3PO4反应,生成HNO2,磷酸是弱酸可以制备亚硝酸,说明亚硝酸为弱酸,故E正确;
F.常温下,将pH=3的亚硝酸溶液稀释10倍,若为强酸PH应为4,若为弱酸,溶液中存在电离平衡,加水稀释又电离溶液pH<4,故F正确;
故答案为:ADEF;
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱,质子就是氢离子.所给微粒中既能结合H+又能提供H+的有H2PO4-、H2O和H2N-CH2COOH,因此这四种物质从酸碱质子理论的角度上看既是酸又是碱,即两性物质,
故答案为:acd;
③HPO42-离子既能发生电离又能发生水解,电离反应式为HPO42-?PO43-+H+,水解反应式为HPO42-+H2O?H2PO4-+OH-,溶液呈碱性,说明水解程度大于电离程度;
由于HPO42-离子和Ca2+离子反应生成沉淀:3Ca2++2HPO42-═Ca3(PO4)2↓+2H+,促进HPO42-的电离,溶液则显酸性,
故答案为:3Ca2++2HPO42-═Ca3(PO4)2↓+2H+;
(5)X、Y、Z各1mol•L-1同时溶于水中制得混合溶液,溶液中的溶质为等物质的量浓度的硝酸钠和亚硝酸钠,亚硝酸钠能水解而使溶液呈碱性,则c(OH-)>c(H+),钠离子和硝酸根离子都不水解,但盐类水解较微弱,所以离子浓度大小关系是c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+);
点评 本题考查了反应自发进行的条件、化学平衡的移动、盐类水解以及离子浓度大小比较,图象的理解应用,考查范围广,题目难度较大.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理来解释的是( )
A.往H2S水溶液中加碱有利于S2﹣增多
B.在二氧化硫的催化氧化反应中,通入过量的空气以提高二氧化硫的转化率
C.高压有利于合成NH3的反应
D.500℃左右比室温更有利于合成NH3的反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列家庭化学小实验不能达到预期目的的是
A.用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物
B.用醋、石灰水验证蛋壳中含有碳酸盐
C.用米汤检验食用加碘盐(含KIO3)中含有碘元素
D.用明矾:KAl(SO4)2·12H2O,可净化水。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡逆向移动了 | B. | 物质A的转化率减小了 | ||
| C. | 物质B的质量分数增大了 | D. | 反应速率增大,且v正>v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.2 | 0.2 | 0.2 |
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:
化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中c(K+)为3mol/L | B. | 上述电解过程中共转移4 mol电子 | ||
| C. | 电解得到的Cu的物质的量为0.5mol | D. | 电解后溶液上c(H+)为4 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com