
分析 (1)相同温度和压强下,气体的体积之比等于物质的量之比等于化学反应方程式的系数之比,据此书写方程式,再利用化学反应遵循原子守恒推断;
(2)根据“烧瓶内气体在相同状况下对CH4的相对密度为2”计算出烧瓶内气体的平均摩尔质量;设出空气和氯化氢的体积,根据相同条件下体积之比等于物质的量之比列式计算出空气与HCl的体积比;设出烧瓶的体积,根据n=$\frac{V}{{V}_{m}}$、c=$\frac{n}{V}$计算出烧瓶中盐酸的物质的量浓度.
解答 解:(1)相同温度和压强下,气体的体积之比等于物质的量之比,等于化学反应方程式的系数之比,所以1体积的X2气体与1体积的Y2气体化合生成2体积的气态化合物Z,反应方程式可以表示为:X2+Y2=2Z,根据原子守恒可知Z为XY,
故答案为:AB;
(2)有一只干燥的烧瓶,在标准状况下用排空气法收集HCl,测得烧瓶内气体在相同状况下对CH4的相对密度为2,气体的摩尔质量与相对密度成正比,则烧瓶内气体的平均摩尔质量为:16g/mol×2=32g/mol;设空气的体积为x、HCl的体积为y,则:$\frac{29x+36.5y}{x+y}$=32,解得:x:y=3:2,即:空气与HCl的体积比为3:2;
将该烧瓶倒置于水槽中,已知HCl全部溶解且假设溶质不从烧瓶中扩散出来,设烧瓶的容积为VL,则烧瓶中含有标准状况下HCl的体积为:VL×$\frac{2}{3+2}$=0.4VL,其物质的量为:$\frac{0.4VL}{22.4L/mol}$=$\frac{0.4V}{22.4}$mol,烧瓶中溶液体积为0.4VL,所以烧瓶中盐酸的物质的量浓度为:$\frac{\frac{0.4V}{22.4}mol}{0.4VL}$=$\frac{1}{22.4}$mol/L,
故答案为:32g/mol;3:2;$\frac{1}{22.4}$mol/L.
点评 本题考查了混合物的计算、物质的量的计算,题目难度中等,明确物质的量与摩尔质量、物质的量浓度等之间的关系为解答关键,试题知识点较多、计算量较大,充分考查了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝的电离方程式:Al2(SO4)3═Al3++SO42- | |
| B. | 氯化钠的电子式: | |
| C. | 甲烷的结构简式:CH4 | |
| D. | 14C的原子结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、CO32-、SO42-、Cl- | B. | Cu2+、NO3-、Cl-、SO42- | ||
| C. | H+、Cl-、K+、CO32- | D. | K+、Mg2+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
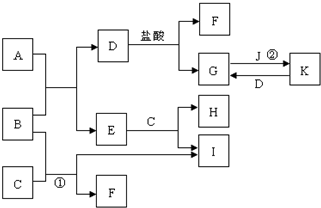 如图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去. A俗称“铁红”,B、D都是日常生活中常见的金属,且B元素是地壳中含量最多的金属元素,常温下,J为黄绿色气体,H为无色气体;C是一种碱,且其焰色反应时,透过蓝色钴玻璃可观察到紫色火焰.
如图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去. A俗称“铁红”,B、D都是日常生活中常见的金属,且B元素是地壳中含量最多的金属元素,常温下,J为黄绿色气体,H为无色气体;C是一种碱,且其焰色反应时,透过蓝色钴玻璃可观察到紫色火焰.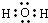 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+一定不存在,Cu2+可能存在 | |
| B. | 一定存在Cl- | |
| C. | 100 mL溶液中含有0.02 mol的CO32- | |
| D. | c(Na+)+c(K+)≥0.4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液的pD=7.0 | |
| B. | 含0.01 mol NaOD的D2O溶液1 L,其pD=12.0 | |
| C. | 溶解0.01 mol DCl于1 L D2O中,其pD=2.0 | |
| D. | 在100 mL 0.25 mol•L-1的DCl的D2O溶液中,加入50 mL 0.2 moL•L-1的NaOD重水溶液中,其pD=1.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com