
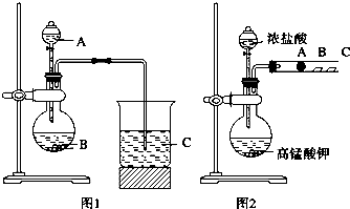
分析 (1)元素的非金属性越强,其最高价含氧酸的酸性越强,已知B为大理石,则试剂A为某元素的最高价含氧酸;
(2)硝酸与碳酸钙反应生成硝酸钙和二氧化碳、水.
解答 解:(1)元素的非金属性越强,其最高价含氧酸的酸性越强,已知B为大理石,则试剂A为某元素的最高价含氧酸,四种溶液中只有①稀硝酸为氮元素的最高价含氧酸,所以试剂A为硝酸;
故答案为:①;
(2)硝酸与碳酸钙反应生成硝酸钙和二氧化碳、水,其反应的离子方程式为:2H++CaCO3=Ca2++CO2↑+H2O;
故答案为:2H++CaCO3=Ca2++CO2↑+H2O.
点评 本题将元素及其化合物、元素周期律与非金属性强弱比较的实验设计结合起来,题目难度不大,注意实验设计的原理和方法,侧重于考查学生的分析能力和实验探究能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 的硫酸溶液中NH4+、Fe2+、Cl-、NO3-可以共存 | |
| B. | 向Ba(OH)2 溶液中滴入硫酸溶液的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| C. | 0.1mol•L-1 AlCl3 溶液,温度从20℃升高到50℃,所有离子浓度均增大 | |
| D. | pH=11的NaOH 溶液中有:[OH-]=[Na+]+[H+] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
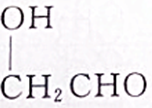 ④
④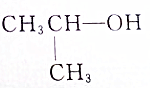
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
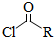 )偶联可用于制备药物Ⅱ:
)偶联可用于制备药物Ⅱ: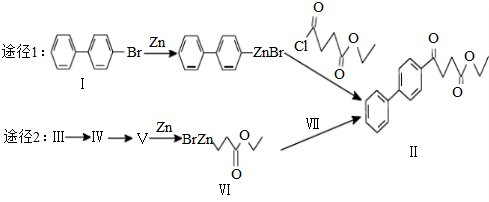
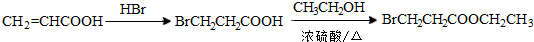 .(标明反应试剂,忽略反应条件).
.(标明反应试剂,忽略反应条件).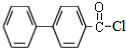 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
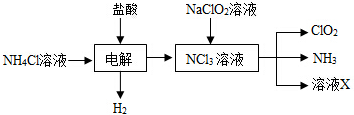

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.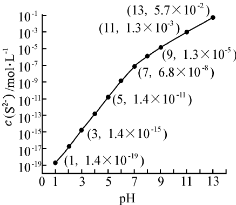
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com