
 镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题:
镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题:
| ||
| 75×4 |
| NA |
| 200 |
| NA |
| ||
| (a×10-10)3 |
| 3×10-32 |
| NAa3 |
| ||
| 3×10-32 |
| NAa3 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、12.5g |
| B、13.2g |
| C、19.7g |
| D、24.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液的体积(mL) | 标准溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.01 | 22.00 |
| 3 | 25.00 | 0.22 | 20.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 用酒精萃取溴水中的溴 |
B、 将硫酸铜溶液直接蒸干得到胆矾 |
C、 说明2NO2(g)?N2O4(g)△H<0 |
D、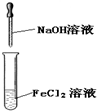 实验室制备Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
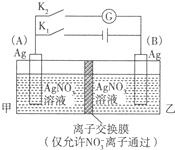 利用如图装置进行实验,甲乙两池均为1mol?L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强).下列说法不正确的是( )
利用如图装置进行实验,甲乙两池均为1mol?L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强).下列说法不正确的是( )| A、闭合K1,断开K2后,A电极增重 |
| B、闭合K1,断开K2后,乙池溶液浓度上升 |
| C、断开K1,闭合K2后,NO3-向B电极移动 |
| D、断开K1,闭合K2后,A电极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ | ||
|
| Fe2+ | ||
|
| OH- | ||
|
| A、在第①反应平衡体系中加入水,溶液中c(H+)增大 |
| B、溶液的pH值不变时,说明第①步反应达平衡状态 |
| C、第②步中,还原0.01mol Cr2O72-离子,需要0.06mol的FeSO4?7H2O |
| D、上述三步转化反应中,只有一个反应为氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com