
可逆反应以A(g)+B![]() C(g)+D达到平衡时,下列说法不正确的是
C(g)+D达到平衡时,下列说法不正确的是
[ ]
A.若增大A的浓度,平衡体系颜色加深,则D一定是有颜色的气体
B.若增大压强,平衡不移动,说明B,D可能都为气体
C.若升高温度,C的体积分数减小,则正反应是放热反应
D.若B是气体,增大B的用量,会使A的转化率增大
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2012-2013学年昆明三中、滇池中学(滇中)高二下期中考试化学卷(带解析) 题型:单选题
某温度下,在容积不变的密闭容器中存在下列可逆反应:A(g)+3B(g) 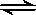 2C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法正确的是
2C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法正确的是
A.平衡不移动 B.平衡时C的物质的量增大
C.平衡向逆反应方向移动 D.平衡时混合气体的平均摩尔质量减少
查看答案和解析>>
科目:高中化学 来源:2010年广东省湛江二中高一第二学期期末考试(理综)化学部分 题型:填空题
(16分)
Ⅰ.可逆反应:A(g)+3B(g) 2C(g)+3D(g),取1 mol A和2 mol B置于2L容器内。1分钟后,测得容器内A的浓度为0.2 mol/L。
2C(g)+3D(g),取1 mol A和2 mol B置于2L容器内。1分钟后,测得容器内A的浓度为0.2 mol/L。
(1)这时B的浓度为________mol/L,C的浓度为________mol/L。
(2)这段时间内反应的平均速率若以D的浓度变化来表示,应为________mol/(L·min)。
(3)如果保持容器内温度不变,反应前和反应后容器内压强之比为_____(最简整数比)。
Ⅱ.电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液。请回答以下问题:
(4)在X极附近观察到的实验现象是:放出气体且______________。检验Y电极反应产物的方法是:把__________________放在Y电极附近,试纸变蓝色。
(5)当通过电解池通过1 mol电子时,两极共收集到________L气体(标准状况),电解池内的液体稀释到500 mL时,NaOH溶液浓度为________mol/L。
查看答案和解析>>
科目:高中化学 来源:2014届昆明三中、滇池中学(滇中)高二下期中考试化学卷(解析版) 题型:选择题
某温度下,在容积不变的密闭容器中存在下列可逆反应:A(g)+3B(g) 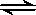 2C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法正确的是
2C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法正确的是
A.平衡不移动 B.平衡时C的物质的量增大
C.平衡向逆反应方向移动 D.平衡时混合气体的平均摩尔质量减少
查看答案和解析>>
科目:高中化学 来源:2010年广东省高一第二学期期末考试(理综)化学部分 题型:填空题
(16分)
Ⅰ.可逆反应:A(g)+3B(g) 2C(g)+3D(g),取1 mol A和2 mol B置于2L容器内。1分钟后,测得容器内A的浓度为0.2 mol/L。
2C(g)+3D(g),取1 mol A和2 mol B置于2L容器内。1分钟后,测得容器内A的浓度为0.2 mol/L。
(1)这时B的浓度为________mol/L,C的浓度为________mol/L。
(2)这段时间内反应的平均速率若以D的浓度变化来表示,应为________mol/(L·min)。
(3)如果保持容器内温度不变,反应前和反应后容器内压强之比为_____(最简整数比)。
Ⅱ.电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液。请回答以下问题:

(4)在X极附近观察到的实验现象是:放出气体且______________。检验Y电极反应产物的方法是:把__________________放在Y电极附近,试纸变蓝色。
(5)当通过电解池通过1 mol电子时,两极共收集到________L气体(标准状况),电解池内的液体稀释到500 mL时,NaOH溶液浓度为________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com