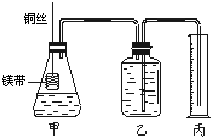
��2010?������ģ�����о���ѧϰ�У�ijʵ��С�������ͭ��ϡ���ᷴӦ��ʵ��̽��������λѧ���������������ʵ�鷽������ͼ��ʾ��

��1��д��ϡ������ͭ��Ӧ�Ļ�ѧ����ʽ
3Cu+8HNO3=3Cu��NO3��2+2NO��+4H2O
3Cu+8HNO3=3Cu��NO3��2+2NO��+4H2O
��
��2����ͬѧ��ͼ1װ�ý���ʵ�飬��Բ����ƿ�м���20mL 6mol/L HNO
3��2g��ͭƬ���ڷ�Ӧ��ʼʱ���ɹ۲쵽ˮ���ڵĵ�����ˮ��������������һ���߶ȣ��˺��ֻ��䣬Ȼ�������ݴӵ��ܿ�ð������˵���������������ԭ��
���ڷ�Ӧ��ʼʱ������NO����ƿ�ڿ�����O2��������NO2��NO2����ˮ����ˮ��Ӧʹװ������ѹ��С��ˮ��������һ���߶Ⱥ���ƿ�е�����ȫ�����ĺ����ɵ�NO�ų����ܿڣ��������ݲ���
���ڷ�Ӧ��ʼʱ������NO����ƿ�ڿ�����O2��������NO2��NO2����ˮ����ˮ��Ӧʹװ������ѹ��С��ˮ��������һ���߶Ⱥ���ƿ�е�����ȫ�����ĺ����ɵ�NO�ų����ܿڣ��������ݲ���
��
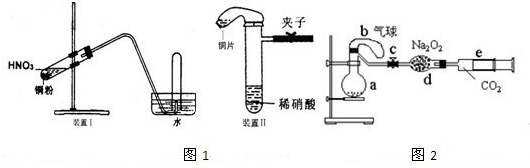
��3����ͬѧ����ʵ������˸Ľ���������ͼ2װ�ý���ʵ�飮
����ʵ���У�ҪʹB�е�����ʼ�ձ�����ɫ���������
�ȹر�a������b��cһ��ʱ�䣬�ٹ�b��a
�ȹر�a������b��cһ��ʱ�䣬�ٹ�b��a
��
���������a��c���ر�b��װ����Һ���Ͽռ�����ΪVmL���������������������Ϊ21%��ʵ���ڱ�״���½��У�ȫ������ͨ����Ӧת��Ϊ���ʵ�鿪ʼʱ�����ͭΪmg��ʵ����Ϻ�ʣ���ͭΪng��������Һ���Ҳ��VmL����������Һ�����ʵ���Ũ����
0.0125mol?L-1
0.0125mol?L-1
��
��4����ͬѧ����ͼ3װ�ý���ʵ�飬����������U�ιܵij��ܿ�ע��ϡ���ᣬһֱע��U�ι̹ܶ��г���Һ��ʱ�������رջ�����ͭ��ϡ���Ὺʼ��Ӧ����NO���壮
�ٵ�
������ͭ˿����Ӵ�
������ͭ˿����Ӵ�
ʱ��Ӧ���Զ�ֹͣ����
U�ι̹ܶ��ϲ�����U�ι�����ϲ���
U�ι̹ܶ��ϲ�����U�ι�����ϲ���
���۲쵽��ɫ��NO���壮
��Ϊ��֤��Cu��ϡHNO
3��Ӧ���ɵ�������NO��������N
2����Ҫ�ļ�����
�ٽ���Һ©���Ļ����������ڷ�Һ©���й۲쵽��������ɫ��Ϊ����ɫ
�ٽ���Һ©���Ļ����������ڷ�Һ©���й۲쵽��������ɫ��Ϊ����ɫ
��
��ͼ3װ����ͼ1��ͼ2װ����ȣ��ŵ���
��̽����ͭ��ϡ���ᷴӦ������ΪNO���ҿ�����֤NO��������NO2�Ĺ��̣�
��̽����ͭ��ϡ���ᷴӦ������ΪNO���ҿ�����֤NO��������NO2�Ĺ��̣�
��

 ��ͭ��ϡ���ᷴӦ�����ӷ���ʽΪ
��ͭ��ϡ���ᷴӦ�����ӷ���ʽΪ

 ��һ����ͬ���ɽ�����ϵ�д�
��һ����ͬ���ɽ�����ϵ�д� ������Ӧ���ϵ�д�
������Ӧ���ϵ�д� ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�



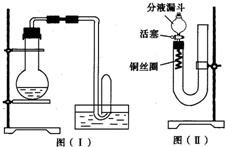 ʵ������ϡ������Cu��Ӧ���Ʊ�NO���������ͼ����װ�ã�������ƿ�ڵĿ��������ų������ɵ�NO�ܿ챻�����ɺ���ɫ��NO2�����۲쵽����ɫ��NO���ɣ���ʹ������ˮ���ռ�����ɫ��NO��Ҳ��˵����������ΪNO����NO2��H2O��Ӧ���ɵģ����������ͼ����װ�ã���������ʵ����Դﵽ�����Ч����
ʵ������ϡ������Cu��Ӧ���Ʊ�NO���������ͼ����װ�ã�������ƿ�ڵĿ��������ų������ɵ�NO�ܿ챻�����ɺ���ɫ��NO2�����۲쵽����ɫ��NO���ɣ���ʹ������ˮ���ռ�����ɫ��NO��Ҳ��˵����������ΪNO����NO2��H2O��Ӧ���ɵģ����������ͼ����װ�ã���������ʵ����Դﵽ�����Ч����