
| A. | 澄清石灰水中通入过量的二氧化碳CO2+OH?═HCO3- | |
| B. | 金属钠和水反应2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 酸性氯化亚铁溶液中加入双氧水2Fe2++H2O2═2Fe3++O2↑+2H+ | |
| D. | 三氧化硫与氯化钡溶液生成沉淀的反应SO3+Ba2++H2O═BaSO4↓+2H+ |
分析 A.氢氧化钙与过量二氧化碳反应生成碳酸氢钙;
B.钠与水反应生成氢氧化钠和氢气;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.三氧化硫为酸性氧化物,与氯化钡溶液反应生成硫酸钡沉淀和氯化氢.
解答 解:A.澄清石灰水中通入过量的二氧化碳,反应生成碳酸氢钙,反应的离子方程式为:CO2+OH?═HCO3-,故A正确;
B.金属钠和水反应生成NaOH和氢气,反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故B正确;
C.酸性氯化亚铁溶液中加入双氧水,双氧水将亚铁离子氧化成铁离子,正确的离子方程式为:2Fe2++2H++H2O2═2Fe3++2H2O,故C错误;
D.三氧化硫与氯化钡溶液生成硫酸钡沉淀反应的离子方程式为:SO3+Ba2++H2O═BaSO4↓+2H+,故D正确;
故选C.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,X的电子式是
,X的电子式是 ,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
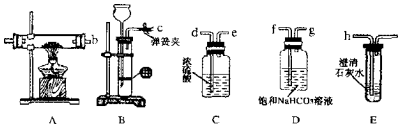
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | B. | Na2O+H2O═2NaOH | ||
| C. | 2KI+Br2═2KBr+I2 | D. | MgO+2HCl═MgCl2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同 | |
| B. | 化学变化发生时,需要断开反应物中的化学键,并形成生成物中的化学键 | |
| C. | CH4和CCl4中,每个原子的最外层都具有8电子稳定结构 | |
| D. | NaHSO4晶体溶于水时,离子键被破坏,共价键不受影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
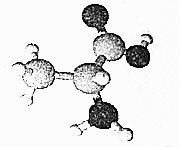
| A. | 常温常压下呈气态 | |
| B. | 分子式为C3H8O2N | |
| C. | 与H2NCH2COOH互为同系物 | |
| D. | 分子中所有C、N原子均处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
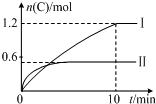 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1实验内容和结果分别如表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1实验内容和结果分别如表和如图所示.下列说法正确的是( )| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1mol | 3mol | 96kJ |
| Ⅱ | 800℃ | 1.5mol | 0.5mol | ─ |
| A. | a=-160 | |
| B. | 600℃时,该反应的平衡常数是0.45 | |
| C. | 实验Ⅰ中,10min内平均速率v(B)=0.06mol•L-1•min-1 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5molA和1.5molB,A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2和O2反应生成水 | B. | 锌片投入稀硫酸中生成H2 | ||
| C. | H2O2分解制取O2 | D. | NH3遇到HCl气体生成白烟 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com