
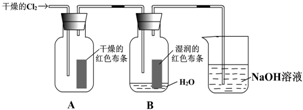
分析 (1)依据氯气是黄绿色气体,密度大于空气密度,有毒的物理性质解答;
(2)氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性,据此解答;
(3)氯气有毒,直接排放到空气中容易造成空气污染,氯气能够与氢氧化钠溶液反应,被氢氧化钠溶液吸收,二者反应生成氯化钠、次氯酸钠和水;
(4)三价铁离子遇到KSCN溶液显血红色,三价铁离子与铁反应生成二价铁离子.
解答 解:(1)氯气是黄绿色气体,密度大于空气密度,氯气泄露,向地势高处转移,故答案为:黄绿; B;
(2)氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性,所以装置中通入Cl2后,集气瓶 A中干燥的红色布条无变化,集气瓶B中湿润的红色布条褪色;
故答案为:褪色; 干燥Cl2没有漂白性,Cl2与水反应生成 HClO有漂白性;
(3)氯气有毒,直接排放到空气中容易造成空气污染,氯气能够与氢氧化钠溶液反应,被氢氧化钠溶液吸收,二者反应生成氯化钠、次氯酸钠和水,反应方程式:Cl2+2NaOH═NaCl+NaClO+H2O;
故答案为:吸收尾气,防止污染空气; Cl2+2NaOH═NaCl+NaClO+H2O;
(4)三价铁离子遇到KSCN溶液显血红色,通常用KSCN溶液检验三价铁离子,三价铁离子与铁反应生成二价铁离子,离子方程式:2Fe3++Fe=3Fe2+;
故答案为:溶液变为红色; 2Fe3++Fe=3Fe2+.
点评 本题考查了元素化合物知识,明确氯气、氯水的成分及性质是解题关键,注意三价铁离子、二价铁离子的影响,题目难度不大.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
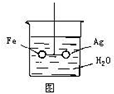 如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.
如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加催化剂同时升高温度 | B. | 降低温度同时增大压强 | ||
| C. | 充入CO | D. | 加催化剂同时增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ③⑤⑥⑦ | D. | ①③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②③ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 | |
| C. | 将四份溶液稀释相同倍数后,溶液的pH:③>④,②>① | |
| D. | 将②、③混合,若pH=7,则消耗溶液的体积:②<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com