
| A. | 长期饮用纯净水,有可能引起一些微量元素缺乏症 | |
| B. | 明矾既能沉降水中的悬浮物,又能杀菌消毒 | |
| C. | 合成洗涤剂和纯碱溶液都可洗去油污,二者去污原理相同 | |
| D. | 纤维素被食用进入人体内,在酶的作用下最终水解为葡萄糖为人体提供能量 |
分析 A.纯净水中缺少一些人体必需的微量元素;
B.明矾没有杀菌消毒作用;
C.洗涤剂去污是乳化作用从而去污;纯碱水解显碱性,促进油污的水解;
D.纤维素在人体内不水解.
解答 解:A.纯净水中缺少一些人体必需的微量元素,所以长期饮用纯净水,有可能引起一些微量元素缺乏症,故A正确;
B.明矾在水中电离出铝离子能水解生成氢氧化铝胶体,胶体能吸附水中的悬浮物而起到净水作用,明矾没有杀菌消毒作用,故B错误;
C.洗涤剂去污是乳化作用从而去污,属于物理变化;纯碱水解显碱性,促进油污的水解,油脂水解生成易溶性物质,发生了化学变化,原理不同,故C错误;
D.纤维素在人体内不水解,不能被人体利用,故D错误.
故选A.
点评 本题考查了洗涤剂的去污原理、胶体的性质、纤维素的性质等,涉及知识点广,均为基础性知识,熟练掌握物质的性质和概念是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用25mL碱式滴定管量取20.00mL KMnO4溶液 | |
| B. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| C. | 将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 | |
| D. | 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的$\frac{2}{3}$,液体也不能蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
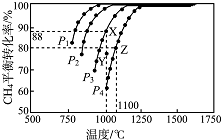 现向一密闭容器中充入物质的量浓度均为0.10mol/L的CH4和CO2,一定条件下发生反应:CH4(g)+CO2( g)═2CO(g)+2H2 (g)△H,测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )
现向一密闭容器中充入物质的量浓度均为0.10mol/L的CH4和CO2,一定条件下发生反应:CH4(g)+CO2( g)═2CO(g)+2H2 (g)△H,测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )| A. | △H>0 | |
| B. | P4>P3>P2>Pl | |
| C. | 1000℃,P3条件下,在Y点:v(正)<v(逆) | |
| D. | 1100℃,P4条件下,该反应的平衡常数K=l.64 (mol/L)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 90 g丙醇中存在的共价键总数为15 NA | |
| B. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol O2转移的电子数为0.2 NA | |
| D. | 2 L 0.5 mol/L亚硫酸溶液中含有的H+离子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
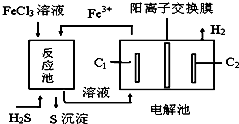
| A. | 电解池中惰性电极C1为阳极 | |
| B. | 该工艺优点之一是FeCl3溶液可循环利用 | |
| C. | 反应池中的离子方程式:2Fe3++S2-=2Fe2++S↓ | |
| D. | 电解池总反应的化学方程式:2FeCl2+2HCl$\frac{\underline{\;通电\;}}{\;}$2FeCl3+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 危化品储存运输过程中发生金属钠、镁着火时,应立即用泡沫灭火器灭火 | |
| B. | 配制银氨溶液的操作:在2 mL 2%的硝酸银溶液中逐滴加入2%的氨水、振荡试管,直至产生的沉淀恰好完全溶解 | |
| C. | 配制230mL 0.1mol•L-1的FeCl3溶液:称取一定质量的FeCl3固体在烧杯中溶于适量盐酸中,放置至室温后,再转移入250mL容量瓶中进行配制 | |
| D. | 取少量硫酸亚铁铵晶体用蒸馏水溶解,加入适量10%的NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝色的气体,说明晶体中含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
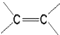 )中的π-键不能自由旋转,因此
)中的π-键不能自由旋转,因此 和
和 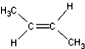 是两种不同的化合物,互为顺反异构体.则分子式为C3H2Cl4的化合物的链状异构体有( )
是两种不同的化合物,互为顺反异构体.则分子式为C3H2Cl4的化合物的链状异构体有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com