
”¾ĢāÄæ”æCo3O4ŹĒÖʱøŹÆÄ«Ļ©µē³ŲÕż¼«²ÄĮĻLiCoO2µÄŌĮĻ”£ŅŌīÜæóŹÆ(Ö÷ŅŖ³É·ÖĪŖCo3S4£¬ŗ¬ÓŠÉŁĮæFeO”¢Fe2O3”¢Al2O3µČŌÓÖŹ)ĪŖŌĮĻÖĘČ”Co3O4µÄ¹¤ŅÕĮ÷³ĢČēĶ¼£ŗ
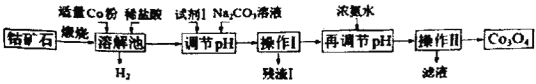
¼ŗÖŖ£ŗCoÓėFeĪŖ»īĘĆ½šŹō£¬Ńõ»ÆŠŌÓÉĒæµ½ČõµÄĖ³ŠņĪŖ£ŗCo3+£¾Fe3+£¾Co2+”£
¼øÖÖĒāŃõ»ÆĪļµÄČܶȻżČēĻĀ±ķ£ŗ
ĒāŃõ»ÆĪļ | Co(OH)2 | Fe(OH)2 | Co(OH)3 | Al(OH)3 | Fe(OH)3 |
ČܶȻż(Ksp) | 2.0”Į10£15 | 8.0”Į10£16 | 2.0”Į10£44 | 1.3”Į10£33 | 4.0”Į10£39 |
ĻĀĮŠÓŠ¹ŲĖµ·Ø“ķĪóµÄŹĒ
A.Čܽā³ŲÖŠÉś³ÉH2µÄĄė×Ó·“Ó¦·½³ĢŹ½ĪŖ£ŗCo+2H+=Co2++H2”ü
B.¼ÓČėŹŌ¼Į1µÄÄæµÄŹĒ½«Fe2+Ńõ»ÆĪŖFe3+£¬ŹŌ¼Į1æÉŃ”ÓĆĖ«ŃõĖ®»ņµāĖ®
C.²ŠŌü1µÄÖ÷ŅŖ³É·ÖĪŖFe(OH)3
D.²Ł×÷¢ņ°üĄØ¹żĀĖ”¢Ļ“µÓ”¢øÉŌļŗĶ×ĘÉÕĖÄøö²½Öč
”¾“š°ø”æBC
”¾½āĪö”æ
īÜæóŹÆÖ÷ŅŖ³É·ÖĪŖCo3S4£¬ŗ¬ÓŠÉŁĮæFeO”¢Fe2O3”¢Al2O3µČŌÓÖŹ£¬ģŃÉÕŗóÓĆŃĪĖįČܽā£¬ČÜŅŗÖŠŃōĄė×ÓÖ÷ŅŖÓŠCo3+”¢Fe3+”¢Al3+¼°Ī“·“Ó¦µÄH+£¬¼ÓČėCo·Ū»įÓŠĒāĘųÉś³É£¬ÓÉÓŚŃõ»ÆŠŌCo3+£¾Fe3+£¾Co2+£¬Co½«Co3+”¢Fe3+»¹ŌĪŖCo2+”¢Fe2+£»øł¾Ż¼øÖÖĒāŃõ»ÆĪļµÄČܶȻżŹż¾Ż£¬ŠčŅŖ½«Fe2+×Ŗ»ÆĪŖFe3+³żČ„£¬Ņņ“Ė¼ÓČėŹŌ¼Į1µÄÄæµÄŹĒ½«Fe2+Ńõ»ÆĪŖFe3+£¬¼ÓČėĢ¼ĖįÄʵ÷½ŚpH£¬Ź¹Fe3+”¢Al3+×Ŗ»ÆĪŖFe(OH)3”¢Al(OH)3³Įµķ£¬¹żĀĖ³żČ„£¬ĀĖŅŗÖŠ¼ÓČėÅØ°±Ė®µ÷½ŚpHŹ¹Co2+×Ŗ»ÆĪŖCo(OH)2³Įµķ£¬¹żĀĖ·ÖĄė£¬Co(OH)2×ĘÉÕµĆµ½Co3O4£¬ĀĖŅŗÖŠŗ¬ÓŠĀČ»ÆÄĘ”¢ĀČ»Æļ§µČ”£¾Ż“Ė·ÖĪö½ā“š”£
A£®CoÓėHCl·¢ÉśÖĆ»»·“Ӧɜ³ÉCoCl2ÓėH2£¬·“Ó¦Ąė×Ó·½³ĢŹ½ĪŖ£ŗCo+2H+=Co2++H2”ü£¬¹ŹAÕżČ·£»
B£®ŹŌ¼Į1ŹĒ½«Fe2+Ńõ»ÆĪŖFe3+£¬µāĖ®²»Äܽ«Fe2+Ńõ»ÆĪŖFe3+£¬Ė«ŃõĖ®æÉŅŌ½«Fe2+Ńõ»ÆĪŖFe3+£¬ĒŅ»¹Ō²śĪļĪŖĖ®£¬¹ŹB“ķĪó£»
C£®¼ÓČėĢ¼ĖįÄʵ÷½ŚpH£¬Ź¹Fe3+”¢Al3+×Ŗ»ÆĪŖFe(OH)3”¢Al(OH)3³Įµķ£¬²ŠŌüIµÄÖ÷ŅŖ³É·ÖĪŖ£ŗFe(OH)3”¢Al(OH)3£¬¹ŹC“ķĪó£»
D£®²Ł×÷¢ņŹĒ½«Co(OH)2¹ĢĢåÓėŅŗĢå·ÖĄė£¬Č»ŗó½«Co(OH)2×ĘÉÕÉś³ÉCo3O4£¬²Ł×÷¢ņ°üĄØ¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ£¬×ĘÉÕĖÄøö²½Öč£¬¹ŹDÕżČ·£»
¹ŹŃ”BC”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©³£ĪĀĻĀ£¬ÓŠpHĻąĶ¬”¢Ģå»żĻąĶ¬µÄ¢ŁŃĪĖįŗĶ¢Ś“×ĖįĮ½ÖÖČÜŅŗ£¬²ÉČ”ŅŌĻĀ“ėŹ©£ŗ
¢Ł¼ÓŹŹĮæ“×ĖįÄĘ¾§Ģåŗó£¬Į½ČÜŅŗÖŠµÄc(H£«)±ä»ÆŹĒ“×ĖįČÜŅŗÖŠc(H£«)___(Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)£¬ŃĪĖįČÜŅŗÖŠc(H£«)___(Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)”£
¢Ś¼ÓĖ®Ļ”ŹĶ10±¶ŗ󣬓×ĖįČÜŅŗÖŠµÄc(H£«)___ŃĪĖįČÜŅŗÖŠµÄc(H£«)(Ģī”°>”±”¢”°£½”±»ņ”°<”±)”£
¢Ū¼ÓµČÅØ¶ČµÄNaOHČÜŅŗÖĮĒ”ŗĆÖŠŗĶ£¬ĖłŠčNaOHČÜŅŗµÄĢå»ż£ŗ“×Ėį___ŃĪĖį(Ģī”°>”±”¢”°£½”±»ņ”°<”±)”£
¢ÜŹ¹ĪĀ¶Č¶¼Éżøß20”ę£¬ČÜŅŗÖŠc(H£«)£ŗ“×Ėį___ŃĪĖį(Ģī”°>”±”¢”°£½”±»ņ”°<”±)”£
¢Ż·Ö±šÓė×ćĮæµÄŠæ·Ū·¢Éś·“Ó¦£¬ĻĀĮŠ¹ŲÓŚĒāĘųĢå»ż(V)Ėꏱ¼ä(t)±ä»ÆµÄŹ¾ŅāĶ¼ÕżČ·µÄŹĒ___(Ģī×ÖÄø)”£
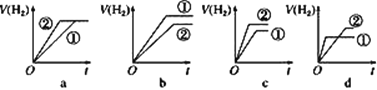
£Ø2£©½«0.1mol”¤L£1µÄCH3COOH¼ÓĖ®Ļ”ŹĶ£¬ÓŠ¹ŲĻ”ŹĶŗó“×ĖįČÜŅŗµÄĖµ·ØÖŠ£¬ÕżČ·µÄŹĒ___(Ģī×ÖÄø)”£
a.µēĄė³Ģ¶ČŌö“ó b.ČÜŅŗÖŠĄė×Ó×ÜŹżŌö¶ą
c.ČÜŅŗµ¼µēŠŌŌöĒæ d.ČÜŅŗÖŠ“×Ėį·Ö×ÓŌö¶ą
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»¶ØĪĀ¶ČĻĀ£¬½«2mol AŗĶ2mol BĮ½ÖÖĘųĢå»ģŗĻÓŚ2LĆܱÕČŻĘ÷ÖŠ£¬·¢Éś·“Ó¦3A(g)+B(g)xC(g)+2D(g)£¬2minÄ©·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬Éś³É0.8mol D£¬²¢²āµĆCµÄÅضČĪŖ0.4mol/L”£ÓÉ“ĖĶʶĻ£ŗ
£Ø1£©xÖµµČÓŚ______________
£Ø2£©BµÄĘ½ŗāÅضČĪŖ_____________
£Ø3£©AµÄ×Ŗ»ÆĀŹĪŖ____________
£Ø4£©Éś³ÉDµÄ·“Ó¦ĖŁĀŹ______________
£Ø5£©Čē¹ūŌö“ó·“Ó¦ĢåĻµµÄŃ¹Ē棬ŌņĘ½ŗāĢåĻµÖŠCµÄÖŹĮæ·ÖŹż____________£ØĢī”°Ōö“ó”±»ņ”°¼õŠ””±»ņ”°²»±ä”±£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æA”«FŹĒ¼øÖÖĢž·Ö×ÓµÄĒņ¹÷Ä£ŠĶ(ČēĻĀĶ¼)£¬¾Ż“Ė»Ų“šĻĀĮŠĪŹĢā£ŗ
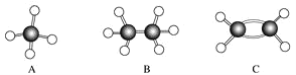
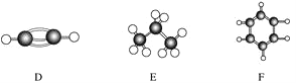
£Ø1£©ŹōÓŚĶ¬ĻµĪļµÄŹĒ________£»
£Ø2£©³£ĪĀĻĀŗ¬Ģ¼Įæ×īøßµÄĘųĢ¬ĢžµÄ·Ö×ÓŹ½ŹĒ____________________________________£»
£Ø3£©Äܹ»·¢Éś¼Ó³É·“Ó¦µÄĢžÓŠ(ĢīŹż×Ö)________ÖÖ£»
£Ø4£©Š“³öCÓėäåµÄĖÄĀČ»ÆĢ¼ČÜŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½________________£»
£Ø5£©Š“³öFÓėäå·¢ÉśČ”“ś·“Ó¦µÄ»Æѧ·½³ĢŹ½___________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµēŹÆĘųŹĒŅ»ÖÖ³£¼ūČ¼ĮĻ£¬C2H2(g) + 5/2 O2(g) £½ 2CO2(g) + H2O(l) ¦¤H ÓŠ¹Ų»Æѧ·“Ó¦µÄÄÜĮæ±ä»ÆČēÓŅĶ¼ĖłŹ¾£¬ŅŃÖŖ¶ĻĮŃ1mol»Æѧ¼üĖłŠčµÄÄÜĮæ£ØkJ£©£ŗO=OĪŖ500”¢C-HĪŖ410£¬Ōņ¶ĻĮŃ1molC”ŌC ¼üĖłŠčµÄÄÜĮæ£ØkJ£©ŹĒ
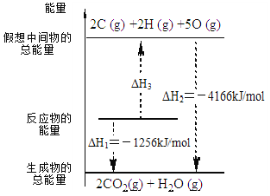
A.840B.1590C.900D.1250
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĒč(CN)2”¢ĮņĒč(SCN)2µČ³ĘĪŖÄāĀ±ĖŲ£¬ĖüĆĒÓėĀ±ĖŲµ„ÖŹŠŌÖŹĻąĖĘ£¬ĖüĆĒµÄŅõĄė×ÓŅ²ÓėĀ±ĖŲŅõĄė×ÓŠŌÖŹĻąĖĘ”£ĄżČē£ŗ2Fe£«3(SCN)2==2Fe(SCN)3”¢Ag£«£«CN£== AgCN”ż(°×)”£ÄāĀ±ĖŲŠĪ³ÉµÄĪŽŃõĖįŗĶŗ¬ŃõĖįŅ»°ć±ČĒāĀ±ĖįŗĶ“ĪĀ±ĖįČõ£¬ŅõĄė×ӵĻ¹ŌŠŌŅ»°ć±ČBr£Ē攣ĻĀĮŠ·“Ó¦ÖŠ£¬²»ÕżČ·µÄŹĒ£Ø £©
A. 2CN££«Cl2= 2Cl££«(CN)2
B. (CN)2£«2OH£=CN££«CNO££«H2O
C. (SCN)2£«H2O = 2H£«£«SCN££«SCNO£
D. MnO2£«4HSCN£ØÅØ£©![]() (SCN)2”ü£«Mn(SCN)2£«2H2O
(SCN)2”ü£«Mn(SCN)2£«2H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓė½šŹōøÆŹ“ÓŠ¹ŲµÄĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
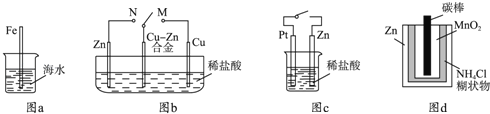
A.Ķ¼aÖŠ£¬²åČėŗ£Ė®ÖŠµÄĢś°ō£¬Ō½ææ½üµ×¶ĖøÆŹ“Ō½ŃĻÖŲ
B.Ķ¼bÖŠ£¬æŖ¹ŲÓÉMøÄÖĆÓŚNŹ±£¬Cu©ZnŗĻ½šµÄøÆŹ“ĖŁĀŹ¼õŠ”
C.Ķ¼cÖŠ£¬½ÓĶØæŖ¹ŲŹ±ZnøÆŹ“ĖŁĀŹŌö“ó£¬ZnÉĻ·Å³öĘųĢåµÄĖŁĀŹŅ²Ōö“ó
D.Ķ¼dÖŠ£¬Zn©MnO2øɵē³Ų×Ō·ÅµēøÆŹ“Ö÷ŅŖŹĒÓÉMnO2µÄŃõ»Æ×÷ÓĆŅżĘšµÄ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³ų·æĄ¬»ų·¢½ĶŅŗæÉĶعżµēÉųĪö·Ø“¦Ąķ£¬Ķ¬Ź±µĆµ½ČéĖįµÄŌĄķČēĶ¼ĖłŹ¾ (Ķ¼ÖŠ HA ±ķŹ¾ČéĖį·Ö×Ó£¬A - ±ķŹ¾ČéĖįøłĄė×Ó) ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ( )
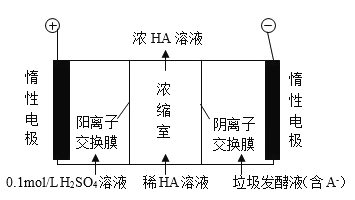
A.Ķصēŗó£¬Ńō¼«ø½½ü pH Ōö“ó
B.µē×Ó“Óøŗ¼«¾µē½āÖŹČÜŅŗ»Ųµ½Õż¼«
C.µ±µēĀ·ÖŠĶعż 2mol µē×ӵĵēĮæŹ±£¬»įÓŠ 1mol µÄ O2 Éś³É
D.Ķصēŗó£¬ A- ĶعżŅõĄė×Ó½»»»Ä¤“ÓŅõ¼«½ųČėÅØĖõŹŅ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ0.05molijӊ»śĪļAŗĶ0.125molO2ŌŚŅ»ĆܱÕČŻĘ÷ÖŠ³ä·ÖČ¼ÉÕ£¬ĖłµĆ²śĪļĶعżÅØH2SO4Ź±Ź¹ĘäŌöÖŲ2.7g£»ŌŁĶعż×ćĮæ×ĘČȵÄCuO·ŪÄ©£¬¹ĢĢåÖŹĮæ¼õŠ”ĮĖ0.8g£»×īŗóĶعż×ćĮæ¼īŹÆ»Ņ£¬¹ĢĢåÖŹĮæŌö¼ÓĮĖ6.6g”£
£Ø1£©øĆ»ÆŗĻĪļAµÄ·Ö×ÓŹ½______________”££ØŠ“³ö¼ĘĖć¹ż³Ģ£©
£Ø2£©Čō0.05molŗ¬ÓŠČ©»łµÄÓŠ»śĪļBÓėÓŠ»śĪļAµÄ×ī¼ņŹ½ĻąĶ¬£¬ĒŅŌŚ0.125molO2ÖŠÄÜĶźČ«Č¼ÉÕ£¬Š“³öBĖłÓŠæÉÄܵĽį¹¹¼ņŹ½______________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com