
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ/mol
2SO3(g) ΔH=-196.6 kJ/mol
2NO(g)+O2(g) ![]() 2NO2(g) ΔH=-113.0 kJ/mol
2NO2(g) ΔH=-113.0 kJ/mol
则反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g)的ΔH=________ kJ/mol。
SO3(g)+NO(g)的ΔH=________ kJ/mol。
(2)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
【答案】(1)-41.8(2)b
【解析】
试题分析:(1)①2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ/mol
2SO3(g) ΔH=-196.6 kJ/mol
②2NO(g)+O2(g) ![]() 2NO2(g) ΔH=-113.0 kJ/mol,根据盖斯定律,NO2(g)+SO2(g)
2NO2(g) ΔH=-113.0 kJ/mol,根据盖斯定律,NO2(g)+SO2(g) ![]() SO3(g)+NO(g)的ΔH=①×
SO3(g)+NO(g)的ΔH=①×![]() -②×
-②×![]() =-41.8kJ/mol;
=-41.8kJ/mol;
(2)NO2(g)+SO2(g) ![]() SO3(g)+NO(g)反应前后气体物质的量不变,体系压强为恒量,体系压强保持不变,不一定平衡;混合气体颜色保持不变,说明NO2浓度不变,一定平衡;SO3和NO的体积比始终是1:1,为恒量,保持不变,不一定平衡;每消耗1 mol SO3的同时生成1 mol NO2,都是指逆反应方向,不一定平衡。
SO3(g)+NO(g)反应前后气体物质的量不变,体系压强为恒量,体系压强保持不变,不一定平衡;混合气体颜色保持不变,说明NO2浓度不变,一定平衡;SO3和NO的体积比始终是1:1,为恒量,保持不变,不一定平衡;每消耗1 mol SO3的同时生成1 mol NO2,都是指逆反应方向,不一定平衡。


科目:高中化学 来源: 题型:
【题目】pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol/L,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5mol/L,可认为该离子不存在)。下列说法不正确的是

A.某温度下,CO2饱和溶液的浓度是0.05 molL-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度为0.1% ,
B.25℃时,H2CO3一级电离平衡常数的数值Ka1=10-6
C.向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32﹣)+c(OH﹣)+c(HCO3﹣)
D.25℃时,0.1mol/LNa2CO3中c(HCO3﹣)比0.1mol/LH2CO3中c(HCO3﹣)大
查看答案和解析>>
科目:高中化学 来源: 题型:
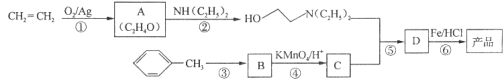
【题目】乙烯用途广泛,工业上可通过下列流程合成二甘醇及其衍生物。已知:R-OH+SOC12=R-C1+SO2↑+HC1↑,请回答:

(1)写出有关物质的结构简式:A__________、D__________。
(2)指出反应类型:①__________,②__________。
(3)写出下列化学方程式:反应①__________;反应②__________。
(4)二甘醇又名(二)乙二醇醚.根据其结构判断下列说法正确的是__________(填序号)
A.难溶于水B.沸点较高C.不能燃烧D.可与金属钠反应
(5)E的同分异构体很多,指出同时符合下列条件的同分异构体的数目有__________种,
①属于链状结构②羟基不能直接连在不饱和碳原子上
③不含有“O=C=C”或“C=C=C”结构④不考虑各种立体异构
并写出其中能够发生银镜反应的所有异构体的结构简式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修2:化学与技术] 工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为: ;
②硫酸钠和焦炭、石灰石反应的化学方程式为: (已知硫酸钠做氧化剂,生成物中气体只有一种)。
(2)氨碱法的工艺如图所示,得到的碳酸氢钠经煅烧生成纯碱。

①图中的中间产物C是_______,(填化学式,下同)D是_______;
②装置乙中发生反应的化学方程式为 。
(3)联合制碱法是对氨碱法的改进,其优点是除了副产物氯化铵可用作化肥外还有______________。
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。下列说法不正确的是
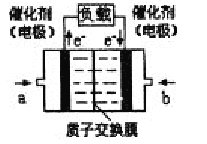
A.右电极为电池正极,b处通入的物质是空气
B.左电极为电池负极,a处通入的物质是空气
C.负极反应式为:CH3OH+H2O-6e—=CO2+6H+
D.正极反应式为:O2+4H++4e—=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】盐酸普鲁卡因(![]() )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
已知:①![]()
②![]()
③
请回答以下问题:
(1)A的核磁共振氢谱只有一个峰,则A的结构简式为____________________。
(2)C的结构简式为__________,C中含有的含氧官能团的名称为__________。
(3)合成路线中属于氧化反应的有_________(填序号),反应③的反应类型为_______________。
(4)反应⑤的化学反应方程式为______________________________________________。
(5)B的某种同系物E,相对分子质量比B大28,其中—NO2与苯环直接相连,则E的结构简式为____________________(任写一种)。
(6)符合下列条件的E的同分异构体的数目有__________种。
①结构中含有一个“—NH2”与一个“—COOH” ②苯环上有三个各不相同的取代基
(7)苯丙氨酸(![]() )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式____________________________________________________________。
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在5 L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。起始反应时NO和CO各为3 mol,保持密闭容器体积不变,10秒钟达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是
N2(g)+2CO2(g)。起始反应时NO和CO各为3 mol,保持密闭容器体积不变,10秒钟达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是
A.达到平衡后,若将容器体积压缩为2 L,则正反应速率将增大,逆反应速率将减小
B.反应前5秒钟内,用CO表示的平均反应速率为0.04 mol·L-1·s-1
C.当v正(CO)=2v逆(N2)时,该反应中NO的物质的量不再改变
D.保持压强不变,往容器中充入1 mol He,正、逆反应速率都不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、CO等大气污染气体的处理及利用的方法具有重要意义,可实现绿色环保、节能减排、废物利用等目的。
(1) 利用甲烷催化还原NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJmol﹣1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJmol﹣1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g),500℃时的平衡常数为9,若在该温度下进行,设起始时CO和H2O的起始浓度均为0.020 mol·L-1,则CO的平衡转化率为: 。
H2(g)+CO2(g),500℃时的平衡常数为9,若在该温度下进行,设起始时CO和H2O的起始浓度均为0.020 mol·L-1,则CO的平衡转化率为: 。
(3) 用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示。
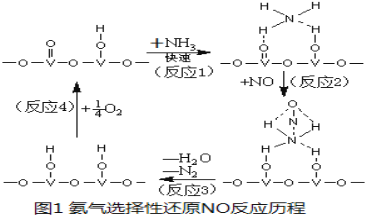
①写出总反应化学方程式 。
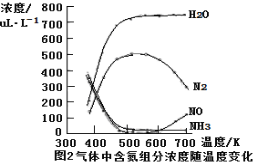
②测得该反应的平衡常数与温度的关系为:lgK=5.08+217.5/T,该反应是 反应(填“吸热”或“放热”)。
③该反应的含氮气体组分随温度变化如图2所示,当温度达到700K时,发生副反应的化学方程式 。
(4)下图是用食盐水做电解液电解烟气脱氮的一种原理图,NO被阳极产生的氧化性物质氧化为NO3—,尾气经氢氧化钠溶液吸收后排入空气。如下图,电流密度和溶液pH对烟气脱硝的影响。
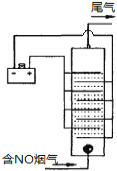
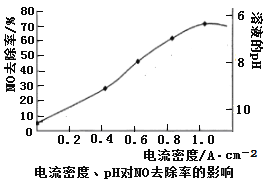
①NO被阳极产生的氧化性物质氧化为NO3-反应的离子方程式 。
②溶液的pH对NO去除率影响的原因是 。
③若极板面积10cm2,实验烟气含NO 1.5%,流速为0.070L·s-1(气体体积已折算成标准状态,且烟气中无其他气体被氧化),法拉第常数为96500 C·mol-1,测得电流密度为1.0 A·cm-2。列式计算实验中NO除去率 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异苯丙醛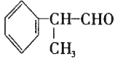 在工业上有重要用途,其合成流程如下:
在工业上有重要用途,其合成流程如下:

(1)异苯丙醛被酸性高锰酸钾氧化后所得有机物的结构简式是____________。
(2)在合成流程上②的反应类型是____________,反应④发生的条件是____________,
(3)反应⑤的化学方程式为____________。
(4)异苯丙醛发生银镜反应的化学方程式为__________。
(5)D物质与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的名称是____________。D物质有多种同分异构体,其中满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有____________种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com