
| A. | 常温常压下CH4是液体 | B. | 一氯甲烷分子式为CH4Cl | ||
| C. | CH4与Cl2可以发生加成反应 | D. | CH4完全燃烧生成CO2和H2O |
科目:高中化学 来源: 题型:解答题
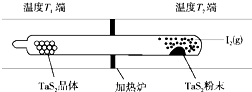 化学反应原理在科研和生产中有广泛应用.
化学反应原理在科研和生产中有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | |
| W |
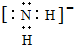
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铜与硫酸溶液反应 OH-+H+═H2O | |
| B. | 铁与稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| C. | 铁和硫酸铜溶液反应 Fe+Cu2+═Cu+Fe2+ | |
| D. | 碳酸钙与盐酸溶液反应 CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力提倡开发化石燃料作为能源 | |
| B. | 研发新型催化剂,提高石油和煤中各组分的燃烧热 | |
| C. | 化石燃料属于可再生能源,不影响可持续发展 | |
| D. | 人类应尽可能开发新能源,取代化石能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.
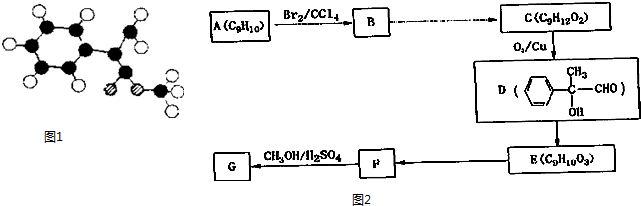
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.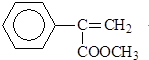 .
.
 .
.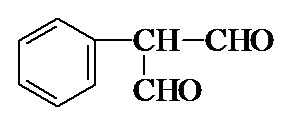 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,14 g乙烯中含碳原子数为NA | |
| B. | 1 mol NH4+与1 mol OH-所含的电子数均为10NA | |
| C. | 常温常压下,22.4L CH4中含C-H键数目为4NA | |
| D. | 常温下,pH=13的NaOH溶液中含OH-数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com