
 英国科学家安德烈•海姆和康斯坦丁•诺沃肖洛夫因在石墨烯(如图)材料方面的卓越研究而获得2010年诺贝尔物理学奖.六方氮化硼(BN)与石墨是等电子体,它有“白石墨”之称,具有类似石墨的层状结构,有良好的润滑性.C、N、B的第一电离能由大到小的顺序为N>C>B,电负性由小到大的顺序为B<C<N.
英国科学家安德烈•海姆和康斯坦丁•诺沃肖洛夫因在石墨烯(如图)材料方面的卓越研究而获得2010年诺贝尔物理学奖.六方氮化硼(BN)与石墨是等电子体,它有“白石墨”之称,具有类似石墨的层状结构,有良好的润滑性.C、N、B的第一电离能由大到小的顺序为N>C>B,电负性由小到大的顺序为B<C<N. 科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5 | |
| C. | ①与③等体积混合后溶液PH为a,②与④等体积混合后溶液PH为b.则a>b | |
| D. | 1ml③和100ml④分别与足量金属镁反应,产生的H2一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
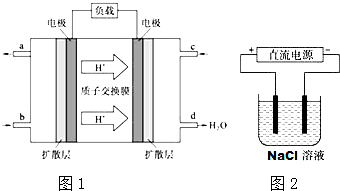
 用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.
用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 流出溶液的体积为(m-n) mL | B. | 流出溶液的体积为(n-m) mL | ||
| C. | 管内溶液体积等于(a-n) mL | D. | 管内溶液体积多于n mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
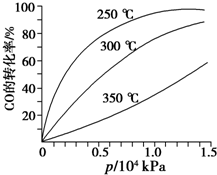 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com