
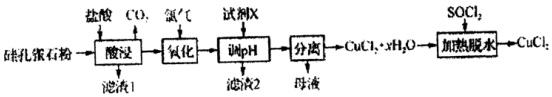
分析 以硅孔雀石[主要成分为CuCO3•Cu(OH)2、CuSiO3•2H2O,含SiO2、FeCO3、Fe2O3等杂质]加入盐酸酸浸生成二氧化碳气体,过滤得到滤渣1为SiO2 ,H2SiO3,滤液中通入氯气氧化亚铁离子为铁离子,加入氧化铜或氢氧化铜或碱式碳酸铜调节溶液PH沉淀铁离子,过滤得到滤渣2为氢氧化铁沉淀,滤液浓缩蒸发,冷却结晶得到氯化铜晶体,加入SOCl2加热脱水得到氯化铜,以此解答该题.
解答 解:(1)“酸浸”时盐酸与CuCO3•Cu(OH)2反应为复分解反应,由此确定产物配平得化学方程式为CuCO3•Cu(OH)2+4HCl═2CuCl2+CO2↑+3H2O,为提高“酸浸”时铜元素的浸出率,可:①适当提高盐酸浓度;②适当提高反应温度;③适当加快搅拌速率、适当延长酸浸时间,
故答案为:CuCO3•Cu(OH)2+4HCl═2CuCl2+CO2↑+3H2O;适当加快搅拌速率、适当延长酸浸时间;
(2)硅孔雀石主要成分为CuCO3•Cu(OH)2、CuSiO3•2H2O,含SiO2、FeCO3、Fe2O3等杂质,根据流程图,加盐酸“酸浸”后溶液中只有Fe2+可被氯气氧化,“氧化”时发生反应的离子方程式为Cl2+2Fe2+═2Fe3++2Cl-,
故答案为:Cl2+2Fe2+═2Fe3++2Cl-;
(3)加入X用于调节溶液的pH,但不能引入新杂质,可用CuO、Cu(OH)2等,故答案为:cd;
(4)根据流程图,经氧化后溶液中阳离子主要为Cu2+和Fe3+,加试剂X调节pH使Fe3+完全沉淀而除去,Cu2+仍留在溶液中,实现Cu2+和Fe3+的分离,最终制备CuCl2;“调pH”时,pH不能过高,否则Cu2+转化为Cu(OH)2沉淀,
故答案为:Fe(OH)3;防止Cu2+转化为Cu(OH)2沉淀;
(5)由已知:SOCl2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+2HCl↑,“加热脱水”时,加入SOCl2的目的是生成的HCl抑制CuCl2的水解.(1)CuCO3•Cu(OH)2+4HCl═2CuCl2+CO2↑+3H2O,
故答案为:生成的HCl抑制CuCl2的水解.
点评 本题借助硅孔雀石为原料制取硫酸铜的工艺流程,为高考常见题型,侧重考查学生的分析能力和实验能力,题目涉及化学方程式书写、氧化还原反应等知识,注意把握实验的原理,本题难度中等.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 放热反应不需要加热就能发生 | |
| B. | 升高温度或加入催化剂,均可以改变化学反应的反应热 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 | |
| D. | 物质发生化学变化,一定伴随着能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能、氢能、风能、地热能、海洋能和生物质能等属于新能源 | |
| B. | 根据能量守恒定律,生成物总能量一定等于反应物总能量 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 吸热反应在常温下一定不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验操作 | 实验现象 | 解释与结论 |
| A | 向浓度均为0.1mol•L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 硝酸银溶液中加足量的NaCl溶液,再加KI溶液 | 先得到白色沉淀后变为黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | 相同时间内,HA收集到的氢气多 | HA是弱酸 |
| D | 用洁净的铂丝蘸待测液进行焰色反应 | 火焰呈黄色 | 溶液中含Na+,不含K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化时要吸收大量的热,常用作制冷剂 | |
| B. | 加快清洁能源发展、加强污染物达标排放检查是治理雾霾的有效措施 | |
| C. | 为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土 | |
| D. | 氢氧化铝、碳酸钠都是常见的胃酸中和剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1 molCO、2 mol H2 | 1mol CH3OH | 2mol CH3OH | |
| 衡 时 数据 | CH3OH的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | a kJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | a1 | a2 | a3 | |
| A. | 2 c1>c3 | B. | |a|+|b|=90.8 | C. | 2 p2<p3 | D. | a1+a3<1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com