
【题目】根据要求回答下列问题:
I. 写出下列物质或微粒的电子式:
(1)CO2_________________
(2)N2__________________
(3) Na2O_____________
(4)NaOH________________
II. 下列物质:①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧ I2 ⑨He
(1)含有共价键的离子化合物是(用序号回答)_____________
含有共价键的共价化合物是(用序号回答)_______________
(2)当其熔化时,不破坏化学键的是(用序号回答)______________.
【答案】 ![]()
![]()
![]()
![]() ③⑤⑥ ②④⑦ ②④⑦⑧⑨
③⑤⑥ ②④⑦ ②④⑦⑧⑨
【解析】I. (1)CO2是共价化合物,电子式为![]() ; (2)N2分子中存在氮氮三键,电子式为
; (2)N2分子中存在氮氮三键,电子式为![]() ;(3) Na2O是离子化合物,电子式为
;(3) Na2O是离子化合物,电子式为![]() ;(4)NaOH是含有离子键和共价键的离子化合物,电子式为
;(4)NaOH是含有离子键和共价键的离子化合物,电子式为![]() ;
;
II. ①CaBr2是含有离子键的离子化合物;②H2O是含有共价键的共价化合物;③NH4Cl是含有离子键和共价键的离子化合物;④H2O2是含有共价键的共价化合物;⑤Na2O2是含有离子键和共价键的离子化合物;⑥Ca(OH)2是含有离子键和共价键的离子化合物;⑦HClO是含有共价键的共价化合物;⑧I2是含有共价键的单质;⑨He是稀有气体分子,不存在化学键,则
(1)根据以上分析可知含有共价键的离子化合物是③⑤⑥;含有共价键的共价化合物是②④⑦;(2)当其熔化时破坏的是离子键,共价键不变,则不破坏化学键的是②④⑦⑧⑨。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关常见的几种金属氧化物的性质和用途的说法不正确的是( )
A. 氧化钙可用作干燥剂 B. Fe2O3可用于制作红色油漆和涂料
C. Al2O3可用作耐火材料 D. Na2O2、CuO、FeO都能溶于水,且与水反应都生成相应的碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在容积为10L固定的密闭容器中充入4molNH3和5molO2发生如下反应:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),5s后,达到平衡并生成1molNO时:
4NO(g)+6H2O(g),5s后,达到平衡并生成1molNO时:
(1)O2的转化率为__________________。
(2)下列能说明该反应已经达到平衡状态的是____________。(填字母选项)
A.容器中气体总质量不变 B.c(O2)不变
C.5v(O2)正 = 4v(NO)逆 D.体系压强不变
(3)降低容器的温度则反应速率______,向该容器中通入Ar,则反应速率_______(选填“增大”、“减小”、“不变”)。
(4)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因是________。(填字母选项)。
A.反应体系温度先升高后降低,所以反应速率是先增大后减小
B.反应物浓度先升高后降低,所以反应速率先增大后减小
C.该反应为放热反应,在反应开始阶段,主要受体系温度升高的影响,反应速率增大;在反应后阶段,主要受浓度减小因素的影响,反应速率减慢
(5)已知对于可逆化学反应mA + nB ![]() pC + qD在一定温度下达到化学平衡时,其平衡常数K的表达式为:
pC + qD在一定温度下达到化学平衡时,其平衡常数K的表达式为:![]() (其中,C为各物质的平衡浓度),则该温度下,上述反应的平衡常数K = ___________________________(用数据表达,列出式子即可)。
(其中,C为各物质的平衡浓度),则该温度下,上述反应的平衡常数K = ___________________________(用数据表达,列出式子即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Na2CO3溶液中CO32-水解:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. Fe3O4溶于稀HNO3:3Fe3O4+28H++NO3- = 9Fe3++NO↑+14H2O
C. 少量的SO2通入NaClO溶液:SO2+ClO-+H2O=SO42-+Cl-+2H+
D. 向含Ba(OH)2和KOH均为0.1mol的混合溶液中通入标准状况下4.48LCO2气体:Ba2++3OH-+2CO2=BaCO3↓+HCO3-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是 ( )
A. CS2为V形的极性分子 B. ClO3—的空间构型为平面三角形
C. SiF4和SO32—的中心原子均为sp2杂化 D. SF6中有6对相同的成键电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷为同主族元素,回答下列问题:
(1)基态As原子的核外电子排布式为_______。
(2)镓氮砷合金材料的太阳能电池效率达40%,这3种元素的电负性由大至小的顺序是______ (用元素符号表示)
(3)As4O6的分子结构如左下图所示,其中As原子的杂化方式为______________,1 mol As406含有σ键的物质的量为_______。


(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右上图所示。则Y轴可表示的氢化物(RH3)性质可能是__________。
A.稳定性 B.沸点 C.R-H键能 D.分子间作用力
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是_____________________
(6)NH4+中的H—N—H的键角比 NH3中的H—N—H的键角_______(填”大”或”小”),原因是_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 18克的D216O中含有的中子数为9NA
B. 标准状况下,22.4LSO3含有的原子数为4NA
C. 80ml10mol/L盐酸与足量MnO2加热反应,产生的Cl2分子数为0.2NA
D. 精炼铜过程中,阳极质量减少6.4g时,电路中转移电子为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应:A(g)+B(s)![]() C(s)+D(g) ΔH>0。如图所示为正、逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤减少C,符合图示条件的是( )
C(s)+D(g) ΔH>0。如图所示为正、逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤减少C,符合图示条件的是( )
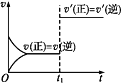
A. ②③ B. ①② C. ③④ D. ④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com