
 Fe(OH)2 + Ni(OH)2��
Fe(OH)2 + Ni(OH)2��| A��NiO2 | B��Fe | C��Fe(OH)2 | D��Ni(OH)2 |
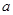 g M�������M�����ԭ������Ϊ ���ú���
g M�������M�����ԭ������Ϊ ���ú���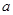 ��x���ı���ʽ��ʾ����
��x���ı���ʽ��ʾ���� 

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
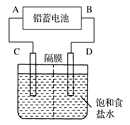
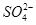 ��2e��===PbSO4
��2e��===PbSO4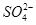 ��2e��===PbSO4��2H2O
��2e��===PbSO4��2H2O�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����п���������� | B������������������ | C�������� | D����ͭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���õ��߽���Ƭ��ͭƬ���Ӻ���һʢ��ϡ H2SO4��Һ���ձ��� |
| B��CuƬ����������Ƭ�����������һ������H2SO4��Һ |
| C��CuƬ����������Ƭ�����������һ������H2SO4��Һ |
| D������Ƭֱ�ӷ���һʢ��ϡ H2SO4��Һ���ձ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ϡH2SO4��Ӧʱ����������CuSO4��Һ����ʹ��Ӧ���ʼӿ� |
| B������ԭ��ص������������������ֲ�ͬ�Ľ��� |
| C������Ƭ�϶�ͭʱ������ͭ������ |
| D���ö��Ե缫���CuSO4��Һ����Һ��pH���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ͭпԭ�����ͭ�Ǹ��� | B���õ�ⷨ������ͭʱ����ͭ������ |
| C���ڶƼ��ϵ��ͭʱ���ý���ͭ������ | D�����ϡ������H2��O2ʱͭ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
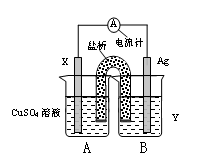
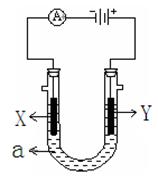
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com