
| A. | 低温、低压 | B. | 低温、高压 | C. | 高温、高压 | D. | 高温、低压 |
科目:高中化学 来源: 题型:解答题
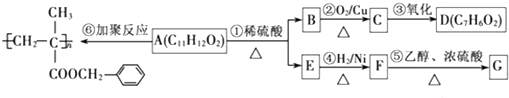
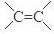 、-COOH;F的名称2-甲基丙酸(系统命名法命名).
、-COOH;F的名称2-甲基丙酸(系统命名法命名).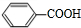 .
.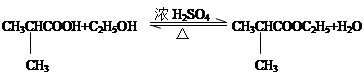 .⑤的反应类型是酯化反应(或取代反应).
.⑤的反应类型是酯化反应(或取代反应).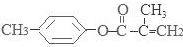 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8gNH${\;}_{4}^{+}$和2.3gNa+所含的电子数均为NA | |
| B. | 0.4molCu与0.8molHNO3(稀)反应,转移电子数为0.8NA | |
| C. | 3.2gCu与足量的HNO3(浓)反应生成的气体分子数为0.1NA | |
| D. | 1molCl2与足量的铁反应,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v1增大,v2减小 | B. | v1减小,v2增大 | C. | 同时增大 | D. | 同时减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
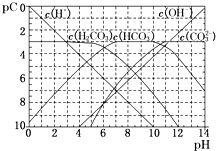 研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义.某学习小组查阅资料并进行相关探究,请帮忙完成以下探究.
研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义.某学习小组查阅资料并进行相关探究,请帮忙完成以下探究.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
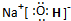 ,写出③中生成盐的化学键类型离子键和共价键.
,写出③中生成盐的化学键类型离子键和共价键.| 物质 | F(OH)2 | I(OH)3 |
| Ksp | 5.61×10-12 | 2.64×10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠铝合金 | B. | Na2O和Al2O3 | C. | 明矾和BaO | D. | MgO和SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com