
下列关于原子半径和第一电离能的变化趋势的叙述中,正确的是
A.同周期元素的原子半径随着核电荷数的增大而增大
B.同主族元素的原子半径随着核电荷数的增大而增大
C.同周期元素的第一电离能随着核电荷数的增大而增大
D.同主族元素的第一电离能随着核电荷数的增大而增大
科目:高中化学 来源: 题型:
常温时,下列三种溶液:①0.001 mol·L-1氨水与0.001 mol·L-1HCl溶液等体积混合液 ②pH=3的HCl溶液与pH=11的NaOH溶液等体积混合液 ③pH=11的氨水与pH=3的HCl溶液等体积混合液。其pH大小关系正确的是 )。
A.①=②=③ B.①>②>③
C.①<②=③ D.①<②<③
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示, 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽。接通电路(未闭合K)后发现
为电镀槽。接通电路(未闭合K)后发现 上的c点显红色。为实现铁片上镀铜,接通K后,使c、d两点短路。下列叙述不正确的是( )
上的c点显红色。为实现铁片上镀铜,接通K后,使c、d两点短路。下列叙述不正确的是( )
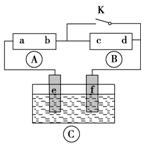
A.b为直流电源的负极
B.f极为阴极,发生还原反应
C.e极材料为铁片,f极材料的铜片
D.可选用CuSO4溶液或CuCl2溶液作电镀液
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.高炉炼铁是冶炼铁的主要方法,发生的主要反应为
Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) ΔH
(1)已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g) ΔH1
C(石墨)+CO2(g)===2CO(g) ΔH2
则ΔH=________(用含ΔH1、ΔH2代数式表示)
(2)高炉炼铁反应的平衡常数表达式K=________。
(3)在T ℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为________。
②下列说法正确的是________(填字母)。
A.若容器压强恒定,反应达到平衡状态
B.若容器内气体密度恒定,反应达到平衡状态
C.甲容器中CO的平衡转化率大于乙的
D.增加Fe2O3就能提高CO的转化率
Ⅱ.纳米MgO可用尿素与氯化镁合成。某小组研究该反应在温度在378~398 K时的反应时间、反应物配比等因素对其产率的影响。请完成以下实验设计表:
| 编号 | 温度/K | 反应 时间/h | 反应物物质 的量配比 | 实验目的 |
| ① | 378 | 3 | 3∶1 | 实验②和④探究______________ 实验②和______探究反应时间对产率的影响 |
| ② | 378 | 4 | 4∶1 | |
| ③ | 378 | 3 | ||
| ④ | 398 | 4 | 4∶1 |
下图为温度对纳米MgO产率(曲线a)和粒径(曲线b)的影响,请归纳出温度对纳米MgO制备的影响:__________________(写出一条)。
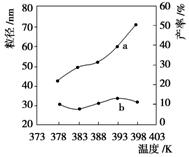
查看答案和解析>>
科目:高中化学 来源: 题型:
下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )。
A.吸氢材料镧镍合金 B.半导体材料砷化镓
C.高温结构陶瓷材料氮化硅 D.透明陶瓷材料硒化锌
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A、X与Y形成化合物是,X可以显负价,Y显正价
B、气态氢化物的稳定性:HmY小于HnX
C、第一电离能可能Y小于X
D、最高价含氧酸的酸性:X对应的酸的酸性弱于Y对应的酸的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应N2(g)+3H2(g)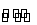 2NH3(g)(正反应为放热反应),下列说法中正确的是( )
2NH3(g)(正反应为放热反应),下列说法中正确的是( )
A.达到平衡后加入N2,当重新达到平衡时,NH3的浓度比原平衡的大,H2的浓度比原平衡的小
B.达到平衡后,升高温度,既加快了正、逆反应速率,又提高了NH3的产率
C.达到平衡后,缩小容器体积,既有利于加快正、逆反应速率,又有利于提高氢气的转化率
D.加入催化剂可以缩短达到平衡的时间,是因为正反应速率增大了,而逆反应速率减小了
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学清洗银镜实验后试管内壁上的银并探究其中的反应原理,进行下列实验。
(1)用稀硝酸可以清洗试管内壁上的银,反应的化学方程式为______________。
(2)为消除(1)中所产生的污染问题,改为如下实验。
| 实验编号 | 操作 | 现象 |
| Ⅰ |
| 剧烈反应,有大量无色气体产生,该气体可以使带火星的木条复燃;反应停止后,试管内壁上的银全部溶解,得到澄清液体a |
①该同学由现象推测H2O2将Ag氧化为Ag+,但通过实验排除了这种可能性。他的操作及现象是:取实验Ⅰ所得液体于试管中,______________;
②经查阅资料,发现:实验Ⅰ中银镜溶解后经一系列反应,最后产物为Ag,但是因为颗粒很小(直径在1~100 nm 间)分散在液体中,肉眼无法识别。该同学设计实验,证实了a中存在直径在1~100 nm间的颗粒。他的操作及现象是:________________;
③写出实验Ⅰ的化学方程式:______________。
(3)进一步探究银的化合物在H2O2分解反应中的作用,进行如下实验。
| 实验 编号 | 操作 | 现象 |
| Ⅱ |
| 振荡,溶液无明显现象 |
| Ⅲ |
| 剧烈反应,产生大量无色气体,同时在试管底部仍有少量黑色固体 |
①实验Ⅱ的目的是____________;
根据实验Ⅲ的现象提出假设:
假设1:Ag2O在H2O2分解反应中作氧化剂;
假设2:Ag2O在H2O2分解反应中作催化剂。
②若假设1成立,请写出该反应的化学方程式:______________;
③结合所给试剂,请设计一个简单的实验证明假设1,并将表格填写完整。
可选试剂:1 mol·L-1盐酸、0.1 mol·L-1氨水、1 mol·L-1 NaOH溶液
| 实验步骤和操作 | 实验现象及结论 |
| 取3 mL 10% H2O2在试管中,加入少量Ag2O,充分反应后,__________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com