氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为 ;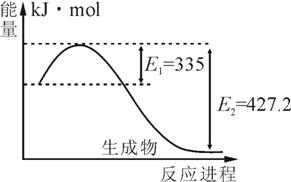
| 20090304
(1) 46.1KJ (2) ① 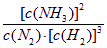 ; < ; ② 0.45mol/(L·min) ; ③ C ; < ; ② 0.45mol/(L·min) ; ③ C (3) NH4+ + D2O NH3·HDO + D+; NH3·HDO + D+; 解析: 略
练习册系列答案
相关习题
科目:高中化学
来源:
题型:阅读理解
Ⅰ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答: (1)在一定体积的恒容密闭容器中,进行如下化学反应:N 2(g)+3H 2(g)  2NH 3(g) 其化学平衡常数K与温度t的关系如下表:
| t/K |
298 |
398 |
498 |
… |
| K/(mol?L-1)2 |
4.1×106 |
K1 |
K2 |
… | 完成下列问题: ①比较K 1、K 2的大小:K 1> > K 2(填“>”、“=”或“<”). ②判断该反应达到化学平衡状态的依据是 AC AC (填序号). A.2v(H 2)(正)=3v(NH 3)(逆) B.v(N 2)(正)=3v(H 2)(逆) C.容器内压强保持不变 D.混合气体的密度保持不变 (2)盐酸肼(N 2H 6Cl 2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH 4Cl类似. ①写出盐酸肼第一步水解反应的离子方程式 N 2H 62++H 2O  [N 2H 5?H 2O] ++H +N 2H 62++H 2O  [N 2H 5?H 2O] ++H +. ②盐酸肼水溶液中离子浓度的排列顺序正确的是 A A (填序号). A.c(Cl -)>c(N 2H 62+)>c(H +)>c(OH -) B.c(Cl -)>c([N 2H 5?H 2O +])>c(H +)>c(OH -) C.c(N 2H 62+)+c([N 2H 5?H 2O +])+c(H +)=c(Cl -)+c(OH -) D.c(N 2H 62+)>c(Cl -)>c(H +)>c(OH -) Ⅱ.水体中重金属铅的污染问题备受关注.查资料得知Pb 4+具有很强的氧化性.水中铅的存在形态主要有Pb 2+、Pb(OH) +、Pb(OH) 2(在水中溶解度小)、Pb(OH) 3-、Pb(OH) 42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示: 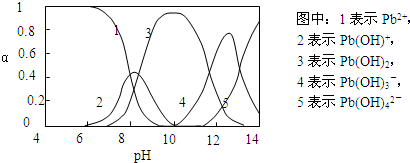 (1)Pb(NO 3) 2溶液中,c(Pb 2+)/c(NO 3-) < < 1/2(填“>”、“=”、“<”). (2)向Pb(NO 3) 2溶液滴加盐酸,溶液中c(Pb 2+)/c(NO 3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为 PbCl2 PbCl2 . (3)向Pb(NO 3) 2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为 10 10 时生成沉淀最多,继续滴加NaOH溶液,混合体系又逐渐变澄清.pH=13时,混合体系中发生的主要反应的离子方程式为: Pb(OH)3-+OH-=Pb(OH)42- Pb(OH)3-+OH-=Pb(OH)42- .
查看答案和解析>>
科目:高中化学
来源:
题型:阅读理解
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义. Ⅰ.硫酸生产中,SO 2催化氧化生成SO 3:2SO 2(g)+O 2(g)?2SO 3(g),混合体系中SO 3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态).  根据图示回答下列问题: ①2SO 2(g)+O 2(g)?2SO 3(g)的△H < < 0.若温度为T 1、T 2,反应的平衡常数分别为K 1、K 2,则K 1> > K 2;若反应进行到状态D时,v 正> > v 逆(填“>”、“<”或“=”). ②若在恒温、恒容条件下向上述平衡体系中通He,V 正不变 不变 (填“增大”、“减小”或“不变”);平衡 不 不 移动(填“向左”、“向右”或“不”). ③若在恒温、恒压条件下向上述平衡体系中通入氦气,V 正减小 减小 ,V 逆减小 减小 ;平衡 向左 向左 移动. Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用. ①如图2是一定的温度和压强下是N 2和H 2反应生成1molNH 3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: N2(g)+3H2(g)═2NH3(g)△H=-2(b-a)kJ?mol-1 N2(g)+3H2(g)═2NH3(g)△H=-2(b-a)kJ?mol-1 (△H的数值用含字母a、b的代数式表示). ②工业合成氨的反应为N 2(g)+3H 2(g) 2NH 3(g).在一定温度下,将一定量的N 2和H 2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 AB AB . A、增大压强 B、增大反应物的浓度 C、使用催化剂 D、降低温度 ③工业合成氨的反应为N 2(g)+3H 2(g) 2NH 3(g).设在容积为2.0L的密闭容器中充入0.60mol N 2(g)和1.60mol H 2(g).反应在一定条件下达到平衡时,NH 3的体积分数为 .计算:该条件下N 2(g)+3H 2(g) 2NH 3(g)的平衡常数为 200 200 ;N 2的平衡转化率为 66.7% 66.7% . ④已知化学反应:N 2(g)+3H 2(g)?2NH 3(g);其化学平衡常数K与温度T的关系如下表:
| T/℃ |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 | 400℃时,在2L的密闭容器中2NH 3(g)?N 2(g)+3H 2(g) 的化学平衡常数K的值为 2 2 .当测得NH 3和N 2、H 2的物质的量分别为12mol和8mol、4mol时,则该反应的v 正(N 2) 大于 大于 v 逆(N 2)(填“大于”、“小于”或“等于”)
查看答案和解析>>
科目:高中化学
来源:
题型:阅读理解
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义. (1)硫酸生产中,SO 2催化氧化生成SO 3:2SO 2(g)+O 2(g)?2SO 3(g),混合体系中SO 3的质量分数和温度的关系如图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:  ①2SO 2(g)+O 2(g)?2SO 3(g)的△H < < 0(选填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 向左 向左 移动(选填“向左”、“向右”或“不”); ②若温度为T 1、T 2,反应的平衡常数分别为K 1、K 2,则K 1> > K 2;若反应进行到状态D时,v 正> > v 逆(选填“>”、“<”或“=”). (2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用. ①图2是一定的温度和压强下N 2和H 2反应生成1mol NH 3过程中能量变化示意图,请写出合成氨的热化学反应方程式: N2(g)+3H2(g)?2NH3(g); N2(g)+3H2(g)?2NH3(g); 、 △H=2(a-b)kJ?mol-1 △H=2(a-b)kJ?mol-1 .(△H的数值用含字母a、b的代数式表示,不必注明反应条件) ②氨气溶于水得到氨水.在25℃下,将xmol?L -1的氨水与ymol?L -1的盐酸等体积混合,所得溶液呈中性.则x > > y,所得溶液中c(NH 4+) = = C(Cl -)(选填“>”、“<”或“=”);用含x和y的代数式表示出一水合氨的电离平衡常数 . (3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在.在25℃下,向0.1mol?L -1的NaCl溶液中逐滴加入适量的0.1mol?L -1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol?L -1的NaI溶液,看到的现象是 白色沉淀转化为黄色沉淀 白色沉淀转化为黄色沉淀 ,产生该现象的原因是(用离子方程式表示) AgCl(s)+I-(aq)=AgI(s)+Cl-(aq) AgCl(s)+I-(aq)=AgI(s)+Cl-(aq) .(已知25℃时K sp[AgCl]=1.0×10 -10 mol 2?L -2,Ksp[AgI]=1.5×10 -16mol 2?L -2)
查看答案和解析>>
科目:高中化学
来源:
题型:阅读理解
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:  (1)如图是N 2和H 2反应生成2molNH 3过程中能量变化示意图,请计算每生成1molNH 3放出热量为 46.1kJ 46.1kJ . (2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递HH +)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N 2+3H 22NH 3,则在电化学合成氨的过程中,阴极反应式为 N2+6H++6e-=2NH3 N2+6H++6e-=2NH3 . (3)在固定体积的密闭容器中,进行如下化学反应:N 2(g)+3H 2(g)  2NH 3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K= | C(N2)?[C (H2) ]3 | | [C (NH3)]2 |
,C(N 2)、C(H 2)、C(NH 3)分别为平衡浓度)
| t/K |
298 |
398 |
498 |
… |
| K/(mol?L-1)-2 |
4.1×106 |
K1 |
K2 |
… | 请完成下列问题: ①试确定K 1的相对大小,K 1< < 4.1×10 6(填写“>”“=”或“<”) ②下列各项能作为判断该反应达到化学平衡状态的依据的是 C C (填序号字母). A.容器内N 2、H 2、NH 3的浓度之比为1:3:2 B.2v(N 2)(正)=v(H 2)(逆) C.容器内压强保持不变 D.混合气体的密度保持不变 (4)①NH 4Cl溶液呈酸性,这是由于NH 4+水解的缘故.则NH 4Cl溶于重水(D 2O)生成一水合氨和水合氢离子的化学式是 NH3?HDO和D3O+ NH3?HDO和D3O+ . ②某氨水的pH=x,某盐酸的pH=y,x+y=14,且x>11,将上述氨水和盐酸等体积混合后,所得溶液中各种离子的浓度由大到小的顺序为 B B A.C(Cl -)>C(NH 4+)>C(H +)>C(OH -) B.C(NH 4+)>C(Cl -)>C(OH -)>C(H +) C.C(Cl -)>C(NH 4+)>C(OH -)>C(H +) D.C(NH 4+)>C(Cl -)>C(H +)>C(OH -)
查看答案和解析>>
科目:高中化学
来源:
题型:
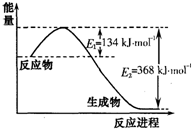 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题: (1)如图是1mol NO 2和1mol CO反应生成CO 2和NO过程中能量变化示意图,请写出NO 2和CO反应的热化学方程式 . (2)在定体积的密闭容器中,进行如下化学反应: N 2(g)+3H 2(g)=2NH 3(g),其化学平衡常数K与t的关系如下表:
| t/K |
298 |
398 |
498 |
… |
| K/(mol?L-1)-2 |
4.1×106 |
K1 |
K2 |
… | 请完成下列问题: ①试比较K 1、K 2的大小,K 1 K 2(填写“>”“=”或“<”) ②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母). A、容器内N 2、H 2、NH 3的浓度之比为1:3:2 B、2v(N 2) (正)=v(H 2) (逆)C、容器内压强保持不变 D、混合气体的密度保持不变 (3)盐酸肼(N 2H 6Cl 2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH 4Cl类似.写出盐酸肼第一步水解反应的离子方程式 .
查看答案和解析>>
| |

