
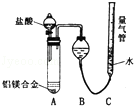
 2011年初,我国“歼20”的试飞引起了世界各国的关注,为减轻飞机的重量,飞机常采用密度较小的镁铝合金作为飞机主体.工厂检测员常通过检测合金中各元素的含量确定合金是否合格.某研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列两种不同实验方案进行探究.填写下列空白.
2011年初,我国“歼20”的试飞引起了世界各国的关注,为减轻飞机的重量,飞机常采用密度较小的镁铝合金作为飞机主体.工厂检测员常通过检测合金中各元素的含量确定合金是否合格.某研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列两种不同实验方案进行探究.填写下列空白.分析 镁铝合金和氢氧化钠溶液反应,铝溶解生成偏铝酸钠和氢气;
实验方案I:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(1)镁的质量分数最小时,金属铝的质量最大,需要的氢氧化钠溶液最多,实际需要氢氧化钠溶液的体积应大于或等于最大值,据此计算;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大;
实验方案Ⅱ:
(3)氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除雾装置;
(4)调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等会影响测定结果.
解答 解:实验方案I:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(1)含镁为零时,金属铝的含量最高,5.4g合金中铝的质量为,5,4g×97%=5.238g,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g 2mol
5.238g V×10-3L×2.0mol/L
所以54g:5.238g=2mol:(V×10-3L×2.0mol/L),
解得:V=97mL,故V(NaOH溶液)≥97mL;
故答案为:97mL;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数偏高,则铝的质量分数偏低,故答案为:偏高;
实验方案Ⅱ:
(3)由于氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除雾装置,故答案为:不需要;
(4)调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等会影响测定结果;
故答案为:调整量气管C的高度,使C中液面与B液面相平;待冷却至室温再读体积.
点评 本题考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:选择题
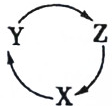 表中各组物质中,不能满足如图所示一步转化关系的是( )
表中各组物质中,不能满足如图所示一步转化关系的是( ) | 选项 | X | Y | Z |
| A | Si | SiO2 | H2SiO3 |
| B | C | CO | CO2 |
| C | SO2 | SO3 | H2SO4 |
| D | Cl2 | HClO | HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al3+ | Fe3+ | AlO2- | SiO32- | |
| 开始沉淀时 | 3.4 | 1.9 | 10.6 | 7.3 |
| 沉淀完全时 | 4.7 | 3.2 | 9.3 | 5.3 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
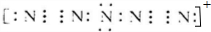 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
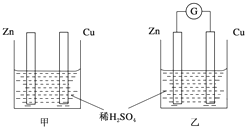 ①分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题:
①分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com