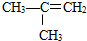【答案】
分析:(1)①分子内氢键使物质的熔沸点降低,分子间氢键使物质的熔沸点升高,根据氢键对物质物理性质的影响分析;
②根据相似相溶原理有机溶质易溶于有机溶剂,无机溶质易溶于无机溶剂,据此分析.
③在加热条件下,铜在空气中能和氧气反应生成氧化铜,氧化铜和乙醇能发生氧化还原反应.
(2)①根据滴定管的特点及准确确定溶液的体积分析;
②酸碱中和滴定时,为了减小方法误差,使滴定终点和等当点重合,需要选择适当的指示剂.
强酸与弱碱相互滴定时,应选用甲基橙.
强碱与弱酸相互滴定时,应选用酚酞.
强酸与强碱相互滴定时,既可选用甲基橙,也可选用酚酞作指示剂.
③滴点终点时,生成物是醋酸钠,醋酸钠是强碱弱酸盐,能水解而使溶液呈碱性,据此分析溶液中离子的浓度大小.
(3)无水醋酸钠和NaOH固体混合加热时能生成CH
4和碳酸钠,根据反应物的状态和反应条件分析;
(4)乙醇和乙酸在浓硫酸、加热条件下能反应生成乙酸乙酯和水;酸与醇反应生成酯和水的反应是酯化反应;
浓硫酸有强氧化性,它本身能被还原成二氧化硫.
解答:解:(1)①乙酸分子间能形成氢键,分子间氢键的存在导致使物质的熔沸点升高,所以乙酸比甲酸甲酯的熔点高.
故答案为:乙酸分子间能形成氢键.
②乙醇能与水互溶,再根据相似相溶原理有机溶质易溶于有机溶剂,无机溶质易溶于无机溶剂,乙醇和油脂都是有机物,所以油脂易溶于乙醇,从而增大了溶液的接触面,加快反应的速率..
故答案为:乙醇易溶于水,油脂易溶于乙醇,从而增大了溶液的接触面.
③在加热条件下,铜在空气中能和氧气反应生成氧化铜,氧化铜和乙醇能发生氧化还原反应生成乙醛、水和铜,CH
3CH
2OH+CuO

CH
3CHO+Cu+H
2O.
故答案为:CH
3CH
2OH+CuO

CH
3CHO+Cu+H
2O.
(2)①滴定管尖嘴部分容易产生气泡,导致所测溶液的浓度产生误差,所以必须除去滴定管尖嘴部分的气泡,使滴定管尖嘴部分充满溶液;
滴定管的“0”刻度在上方,如果溶液的体积在‘0“刻度上方,也导致所测溶液的浓度产生误差,所以要调节液面高度到“0”或“0”刻度以下.
故答案为:除去滴定管尖嘴部分的气泡,使滴定管尖嘴部分充满溶液;调节液面高度到“0”或“0”刻度以下.
②强酸与弱碱相互滴定时,应选用甲基橙.
强碱与弱酸相互滴定时,应选用酚酞.
强酸与强碱相互滴定时,既可选用甲基橙,也可选用酚酞作指示剂.
故选酚酞.
故答案为:酚酞.
③滴点终点时,生成物是醋酸钠,醋酸钠是强碱弱酸盐,能水解而使溶液呈碱性,所以溶液中氢氧根离子的浓度大于氢离子浓度,醋酸钠在水溶液中虽然能水解,但还是以电离为主,所以溶液中钠离子浓度、醋酸根离子远远大于氢氧根离子的浓度;因为醋酸根离子水解,导致钠离子浓度大于醋酸根离子浓度,所以这几种离子浓度的大小顺序为:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
(3)无水醋酸钠和NaOH固体混合加热时能生成CH
4和碳酸钠,CH
3COONa+NaOH

Na
2CO
3+CH
4↑,醋酸钠和氢氧化钠都是固体,且反应条件是加热,所以与NH
3或O
2 的制备装置相同.
故答案为:CH
3COONa+NaOH

Na
2CO
3+CH
4↑; NH
3或O
2.
(4)在加热条件下,乙醇和乙酸在浓硫酸存在下反应生成乙酸乙酯和水,CH
3COOH+CH
3CH
2OH
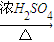
CH
3COOCH
2CH
3+H
2O,该反应是酯化反应;浓硫酸有强氧化性,它本身能被还原成二氧化硫而产生杂质.
故答案为:CH
3COOH+CH
3CH
2OH
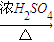
CH
3COOCH
2CH
3+H
2O; 酯化反应; 发生副反应,产生SO
2等有毒气体.
点评:本题考查了乙酸、乙醇的化学性质,难度不大,注意:酸碱中和滴定时,酸碱指示剂一般不用石蕊,其变色范围大,会引起较大误差,酸碱指示剂的正确选择是难点.

 CH3CHO+Cu+H2O.
CH3CHO+Cu+H2O. CH3CHO+Cu+H2O.
CH3CHO+Cu+H2O. Na2CO3+CH4↑,醋酸钠和氢氧化钠都是固体,且反应条件是加热,所以与NH3或O2 的制备装置相同.
Na2CO3+CH4↑,醋酸钠和氢氧化钠都是固体,且反应条件是加热,所以与NH3或O2 的制备装置相同.  Na2CO3+CH4↑; NH3或O2.
Na2CO3+CH4↑; NH3或O2.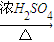 CH3COOCH2CH3+H2O,该反应是酯化反应;浓硫酸有强氧化性,它本身能被还原成二氧化硫而产生杂质.
CH3COOCH2CH3+H2O,该反应是酯化反应;浓硫酸有强氧化性,它本身能被还原成二氧化硫而产生杂质.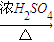 CH3COOCH2CH3+H2O; 酯化反应; 发生副反应,产生SO2等有毒气体.
CH3COOCH2CH3+H2O; 酯化反应; 发生副反应,产生SO2等有毒气体.


 ⑤
⑤