
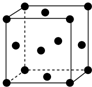
 (1)写出铬原子的基态电子排布式:1s22s22p63s23p63d54s1,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为4.
(1)写出铬原子的基态电子排布式:1s22s22p63s23p63d54s1,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为4.分析 (1)Cr是24号元素,其原子核外有24个电子,根据构造原理书写其原子核外电子排布式;Cr原子最外层电子数是1,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu;
利用均摊法计算该晶胞含有金属原子个数;
(2)非极性分子的溶质极易溶于非极性分子的溶剂;
(3)碳原子价层电子对个数是3的采用sp2杂化;CS2分子中C原子价层电子对个数是2且不含孤电子对,根据价层电子对互斥理论判断空间构型.
解答 解:(1)Cr是24号元素,其原子核外有24个电子,根据构造原理书写其原子核外电子排布式为1s22s22p63s23p63d54s1;Cr原子最外层电子数是1,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu;
利用均摊法计算该晶胞含有金属原子个数,原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,
故答案为:1s22s22p63s23p63d54s1;K、Cu;4;
(2)非极性分子的溶质极易溶于非极性分子的溶剂,CCl4、CS2是非极性分子,CrO2Cl2能与CCl4、CS2等互溶,所以CrO2Cl2是非极性分子,故答案为:非极性;
(3)碳原子价层电子对个数是3的采用sp2杂化,
①苯中每个碳原子价层电子对个数是3,采用sp2杂化;
②CH3OH、⑤CCl4中碳原子价层电子对个数是4,采用sp3杂化;
③HCHO中C原子价层电子对个数是3,采用sp2杂化;
④CS2中C原子价层电子对个数是2,采用sp杂化;
所以C原子采用sp2杂化的是苯、甲醛;
CS2分子中C原子价层电子对个数是2且不含孤电子对,根据价层电子对互斥理论知,空间构型是直线形,
故答案为:①③;直线形.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子核外电子排布、原子杂化、微粒空间构型判断等知识点,利用均摊法、构造原理及价层电子对互斥理论即可解答,注意孤电子对的计算方法,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 乙醇与浓氢溴酸反应CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O | |
| B. | 溴乙烷与氢氧化钠溶液共热CH3CH2Br+NaOH$→_{△}^{水}$ CH3CH2OH+NaBr | |
| C. | 苯酚钠中通入少量的二氧化碳2 ONa+CO2+H2O→2 ONa+CO2+H2O→2 OH+Na2CO3 OH+Na2CO3 | |
| D. | 乙醛催化氧化 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
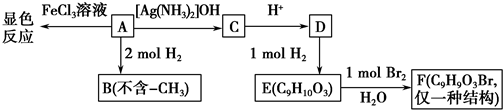
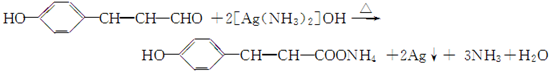 .
. .
. ,G的结构简式为:
,G的结构简式为: .
. .
. 或
或 (写出一个反应方程式即可).
(写出一个反应方程式即可).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
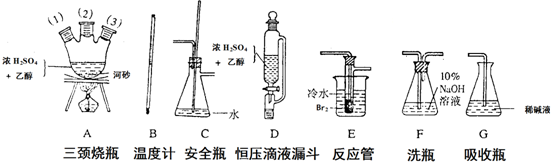
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: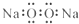 | |
| B. | 硫离子的结构示意图: | |
| C. | NH4Cl的电子式: | |
| D. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O为三角形分子 | |
| B. | N2O与CO2均不含非极性键 | |
| C. | N2O的电子式可表示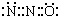 | |
| D. | N2O与SiO2为等电子体、具有相似的结构和相似性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
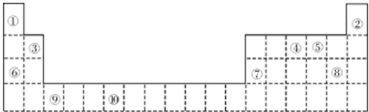
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol. CO(g)+$\frac{1}{2}$O2(g)═CO2(g),△H=-283.0 kJ/mol. C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol. 则4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol | |
| C. | 实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,Ka=$\frac{{{{(cα)}^2}}}{c(1-α)}$.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,Ka变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③④ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com