
| A. | 呈酸性 | B. | 呈中性 | C. | 呈碱性 | D. | 无法判断 |
分析 313K时,水的Kw=3.0×10-14,在313K时,c(H+)=10-7 mol/L的溶液中c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$,根据c(H+)、c(OH-)的相对大小判断溶液酸碱性,据此分析解答.
解答 解:313K时,水的Kw=3.0×10-14,在313K时,c(H+)=10-7 mol/L的溶液中c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{3.0×1{0}^{-14}}{1{0}^{-7}}$=3.0×10-7 mol/L>c(H+)=10-7 mol/L,则溶液呈碱性,
故选C.
点评 本题考查溶液酸碱性判断,判断溶液酸碱性时不能根据pH判断,要根据溶液中c(H+)、c(OH-)的相对大小判断,为易错题.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{5a}{b}$ mol/L | B. | $\frac{10a}{b}$ mol/L | C. | $\frac{b}{5a}$ mol/L | D. | $\frac{a}{b}$ mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应正好达平衡 | |
| B. | 反应向左进行 | |
| C. | 反应向某方向进行一段时间后K<57.0 | |
| D. | 反应向某方向进行一段时间后c(H2)<0.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 有两种同分异构体 | B. | 是非极性分子 | ||
| C. | 只有一种结构,无同分异构体 | D. | 是一种制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下二氧化硅与碳酸钠反应放出二氧化碳,说明硅酸(H2SiO3)的酸性比碳酸强 | |
| B. | 陶瓷、玻璃、水泥容器都能贮存氢氟酸 | |
| C. | 石灰抹墙、水泥砌墙的硬化过程原理不相同 | |
| D. | 硫酸钠溶液、烧碱溶液、硝酸溶液、浓硫酸四种溶液均能用带玻璃塞的试剂瓶保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
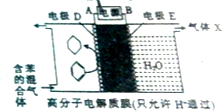
| A. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 | |
| B. | 气体X在反应中通常体现还原性 | |
| C. | 电极D为惰性电极,E为活泼电极 | |
| D. | 外电路电子的移动方向:A→电源→B |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
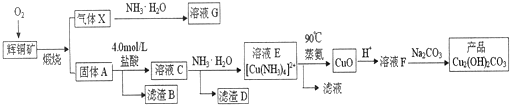
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com