
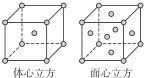
| A. | 元素C形成的单质可以在点燃条件分别与元素A、B、D形成的单质化合,所得化合物均存在共价键 | |
| B. | 元素B、C、D的原子半径由大到小的顺序为:r(D)>rC)>r(B) | |
| C. | 1.0L 0.1mol/L戊溶液中含阴离子总的物质的量小于0.lmol | |
| D. | 1mol甲与足量的乙完全反应共转移约1.204×l024个电子 |
分析 0.1 mol/L 丁溶液的pH为13(25℃),丁是一元强碱,其含有的金属元素在短周期,则丁应为NaOH,发生反应:甲+乙=丁+辛,根据元素守恒可知,甲、乙两种物质至少共含有H、O、Na元素,辛是由C组成的单质,由发生反应可知,辛不能是Na,结合原子数可知,A为H、C为O、D为Na元素,故辛为氧气,可知甲是Na2O2、乙是水,再根据反应:甲+丙=戊+辛,可知丙是二氧化碳,戊是碳酸钠,则B为碳元素,结合对应单质、化合物的性质以及题目要求可解答该题.
解答 解:0.1 mol/L 丁溶液的pH为13(25℃),丁是一元强碱,其含有的金属元素在短周期,则丁应为NaOH,发生反应:甲+乙=丁+辛,根据元素守恒可知,甲、乙两种物质至少共含有H、O、Na元素,辛是由C组成的单质,由发生反应可知,辛不能是Na,结合原子数可知,A为H、C为O、D为Na元素,故辛为氧气,可知甲是Na2O2、乙是水,再根据反应:甲+丙=戊+辛,可知丙是二氧化碳,戊是碳酸钠,则B为碳元素,
A.元素O形成的单质可以在点燃条件分别与元素H、C、Na形成的单质化合,分别得到水,二氧化碳和过氧化钠,所得化合物均存在共价键,故A正确;
B.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径大小顺序为:Na>C>O,即:D>B>C,故B错误;
C.戊是碳酸钠,在碳酸钠溶液中,CO32-离子水解生成HCO3-离子和OH-离子,溶液中阴离子总的物质的量大于0.1mol,故C错误;
D.甲与足量的乙完全反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,1molNa2O2反应转移的电子为1mol,约6.02×1O23个电子,故D错误,
故选A.
点评 本题为元素化合物推断,题目难度中等,需要学生熟练掌握元素化合物知识,对学生的逻辑推理有一定的要求,C选项注意盐类水解.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
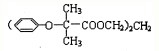 .已知:
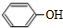
.已知: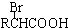 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$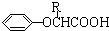
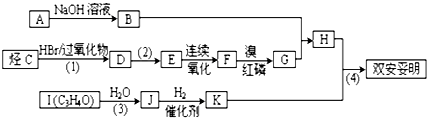
 ,JHOCH2CH2CHO,C化学名称2-甲基-1-丙烯.
,JHOCH2CH2CHO,C化学名称2-甲基-1-丙烯.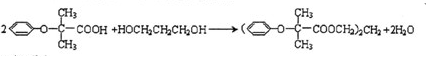 .
.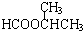 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
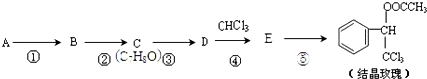
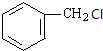
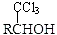 (-R表示烃基)
(-R表示烃基)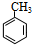 .
. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$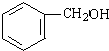 +NaCl.
+NaCl. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2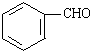 +2H2O.
+2H2O.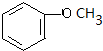 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CO2与一定量的Na2O2反应转移的电子数目一定为0.1NA | |
| B. | C2H2、H2O2、Na2O2的最简式都可以用AB的形式表示 | |
| C. | 50 mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| D. | 2.0 gH218O与D216O的混合物中所含中子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某元素的一种核素的核内质子数为m,中子数为n,由此一定能确定该元素的近似相对原子质量为m+n | |
| B. | 短周期元素X、Y、Z,X的阳离子与Y的阴离子具有相同的电子层结构,Z的阴离子的还原性大于等电荷数Y的阴离子的还原性,那么原子序数大小是Z>X>Y | |
| C. | 第118元素在元素周期表中的位置是第七周期VIA族 | |
| D. | 碱金属单质的熔沸点和卤素单质的熔沸点都是随核电荷数的递增而升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取20.00 g NaOH固体 | |
| B. | 向用水润湿的pH试纸上滴盐酸,可测定盐酸的pH | |
| C. | 用电子分析天平测得铁片质量是15.524 g | |
| D. | 在配制一定物质的量浓度的溶液时,定容后,经摇匀发现液面低于刻度线,此时再加入蒸馏水使其液面与刻度线持平 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁、铝分别与热水反应 | |
| B. | 镁、铝分别与盐酸反应 | |
| C. | 氯化镁溶液、氯化铝溶液分别与氢氧化钠溶液反应 | |
| D. | 将镁-铝-氢氧化钠溶液设计为原电池 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com