
| A. | ①③⑤ | B. | ②③④ | C. | ②④ | D. | ①②③④⑤ |
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解(如铵盐和强碱).
解答 解:①加热KClO3和MnO2的混合物制取O2时二氧化锰只做催化剂,此反应是KClO3的分解反应,故为吸热反应;
②所有的燃烧均为放热反应,故蜡烛的燃烧放热;
③铵盐和碱的反应为吸热反应,故将氢氧化钡晶体和氯化铵晶体的混合物放入水中反应吸热;
④将生石灰倒入海水中发生了CaO和水的化合反应,故为放热反应;
⑤煅烧石灰石发生了碳酸钙的分解反应,故为吸热反应.
故选A.
点评 本题考查化学反应中能量变化,题目难度不大,掌握常见的放热反应和吸热反应是解题的关键.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
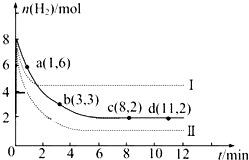 工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:
工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合溶液中逐滴加入0.1mol/l是H2SO4溶液 | |
| B. | 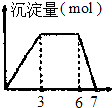 向含0.1mol/L的AlCl3和0.3mol/LNH4Cl的1L混合溶液中逐滴加入0.1mol/l是NaOH溶液 | |
| C. | 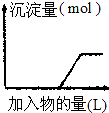 向烧碱溶液中逐滴加入明矾溶液 | |
| D. | 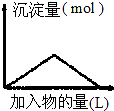 向Ba(OH)2溶液中逐渐通入二氧化碳气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P2O5可用于干燥Cl2和NH3 | |
| B. | 用湿润碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 通过浓硫酸除去HCl中的H2O | |
| D. | 通过灼热的CuO除去H2中的CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和H2催化加热制取氨气 | B. | 加热NH4Cl制取氨气 | ||
| C. | 将浓氨水向氧化钙固体上滴加 | D. | 将NH4Cl溶液和NaOH溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(KJ/mol) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com