
| A. | 将 0.1 mol 氨充分溶解在 1 L 水中 | |
| B. | 将 10 g 质量分数为 98%的硫酸与 990 g 水混合 | |
| C. | 将 8 g 三氧化硫溶于水并配成 1 L 溶液 | |
| D. | 将 0.1 mol 氧化钠溶于水并配成 1L 溶液 |
分析 A、氨气溶于1L水中,所得溶液的体积不是1L;
B、10g质量分数为98%的硫酸溶液中含有9.8g硫酸,物质的量为0.1mol,但是硫酸溶液密度大于1g/mL,溶液的体积小于1L;
C、根据硫酸的物质的量及c=$\frac{n}{V}$计算出所得溶液的物质的量浓度;
D、0.1mol氧化钾与水反应生成0.2mol氢氧化钾.
解答 解:A、将0.1mol氨气充分溶解在1L水中,溶液体积不是1L,所以浓度不是0.1mol•L-1,故A错误;
B、将10g质量分数为98%的硫酸与990g水混合,所得溶液中含有硫酸9.8g,物质的量为0.1mol,溶液质量为1000g,但是硫酸溶液的密度大于1g/mL,溶液的体积小于1L,所以溶液的物质的量浓度大于0.1mol/L,故B错误;
C、8g三氧化硫物质的量为:$\frac{8g}{80g/mol}$=0.1mol,溶于水并配成1L溶液,溶液浓度为0.1mol/L,故C正确;
D、0.1mol氧化钾与水反应生成了0.2mol氢氧化钾,配成1L溶液后的浓度为0.2mol/L,故D错误;
故选C.
点评 本题考查了物质的量浓度计算、一定浓度的溶液配制,题目难度不大,注意掌握物质的量浓度的根据及计算方法,选项A为易错点,注意所得溶液的体积不是1L,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 实验室用大理石和稀盐酸制取二氧化碳:2H++CO32-→CO2↑+H2O | |
| B. | 铁片溶于稀硫酸中:2Fe+6H+→2Fe3++3H2↑ | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-→Al(OH)3↓ | |
| D. | 氢氧化铜溶于稀盐酸中:Cu(OH)2+2H+→2H2O+Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验序号号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
| 1 | 100 | 17.2 | 2.24 |
| 2 | 200 | 8.00 | 4.48 |
| 3 | 400 | 0 | V |
| A. | 表中 V=7.84 L | |
| B. | 原混合物粉末的质量为25.6 g | |
| C. | 原混合物粉未中铁和铜的物质的量之比为2:3 | |
| D. | 实验3所得溶液中硝酸的物质的量浓度为0.875 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 温度相同、体积相同的O2和O3 | B. | 质量相等、密度不等的C2H6和NO | ||
| C. | 质量相等、密度不等的CO和N2 | D. | 体积相等、密度相等的CO2和N2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯的实验式:C3H6 | B. | CO2的电子式: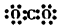 | ||
| C. | 镁离子的结构示意图: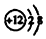 | D. | 中子数为18 的氯原子符号:1718Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气是由氮原子构成的双原子分子,所以化学性质不活泼 | |
| B. | 1 mol N2可与3 mol H2完全反应生成2 mol NH3 | |
| C. | 电闪雷鸣的雨天,雨水中会含有一定量的硝酸,其中发生的反应之一是N2+2O2=2NO2 | |
| D. | NO、NO2在一定条件下可相互转化,且二者都是引起光化学烟雾的大气污染物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
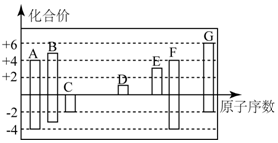 如图是部分短周期元素的常见化合价与原子序数的关系:
如图是部分短周期元素的常见化合价与原子序数的关系: ,其所含化学键类型为离子键和非极性键.
,其所含化学键类型为离子键和非极性键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com