
下列根据实验操作和现象所得出的结论不正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 该溶液中不一定含有SO42﹣ |
B | 步骤1:将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置; 步骤2:向上层溶液中滴加KSCN溶液,再向上层溶液中滴加溴水 | 步骤1现象: 液体分层,下层溶液呈紫色; 步骤2现象: 滴加KSCN溶液,上层溶液不变红;滴加溴水后,上层溶液变红 | 氧化性:Br2>Fe3+>I2 |
C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
D | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年遵义市高二上学期期中考试化学(文)试卷 题型:选择题
下列物质中常温下既能与NaOH溶液反应,又能与盐酸反应产生氢气的是
A.Mg
B.Cl2
C.Si
D.Al
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一10月月考化学试卷(解析版) 题型:选择题
有0.1 mol Na2O和 Na2O2的混合物,溶于水后刚好被100 g 7.3﹪的盐酸中和,则混合物中Na2O和 Na2O2的物质的量之比为
A.11﹕1 B.2﹕1 C.3﹕4 D.任意比
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上第二次月考化学试卷(解析版) 题型:实验题
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。(忽略氧气对反应的影响)
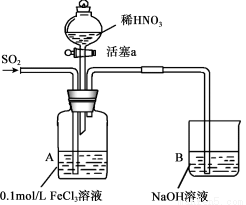
实验记录如下:
实验序号 | 实验操作 | 实验现象 |
I | 向A装置中通入一段时间的SO2气体。 | A中黄色溶液迅速变成深红棕色,最终变为浅绿色。 |
II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液。 | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀。 |
III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a | A中浅绿色溶液最终变为黄色。 |
IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中通入空气。 | 溶液变为红色;液面上方有少量红棕色气体生成。 |
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学方程式和简单文字叙述): 。
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为: Fe3+ + 6SO2  Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因 。
Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因 。
(3)实验II中发生反应的离子方程式是 。
(4)实验III中,浅绿色溶液变为黄色的原因是(用离子方程式表示) 。
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是 。
(6)综合上述实验得出的结论是:在酸性条件下,NO3-、SO42-、Fe3+三种微粒的氧化性由强到弱的顺序是: 。
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上第二次月考化学试卷(解析版) 题型:选择题
下列各种关于酸的使用,其中正确的是( )
A.为了抑制Fe2+的水解,用稀硝酸酸化
B.为了增强KMnO4溶液的氧化能力,用浓盐酸酸化
C.检验溶液中是否含有SO42﹣时,先用盐酸酸化
D.检验氯乙烷中的氯元素,水解后再用硫酸酸化
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上第二次月考化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是( )
A.二氧化硅的分子式 SiO2
B.质子数为53,中子数为78的碘原子 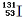
C.羟基的电子式 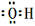
D.次氯酸的结构式:H﹣Cl﹣O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一上学期10月月考化学试卷 题型:选择题
在标准状况下,将aLHCl(气)溶于1L水中(水的密度为1g•c m﹣3),得到的盐酸的密度为bg•mL﹣1,质量分数为w,物质的量浓度为cmol•
m﹣3),得到的盐酸的密度为bg•mL﹣1,质量分数为w,物质的量浓度为cmol• L﹣1则下列关系式中不正确的是
L﹣1则下列关系式中不正确的是
A.w=
B.w=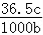
C.C=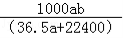
D.b=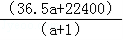
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高二10月阶段性考试化学试卷 题型:填空题
合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g) 2NH3(g)ΔH=-92.4kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g)ΔH=-92.4kJ·mol-1。一种工业合成氨的简式流程图如下:
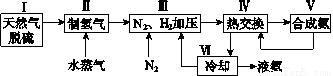
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:_______________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g) CO(g)+3H2(g)△H=+206.4kJ·mol-1
CO(g)+3H2(g)△H=+206.4kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g)△H=-41.2kJ·mol-1
CO2(g)+H2(g)△H=-41.2kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是____________。
a.升高温度b.增大水蒸气浓度c.加入催化剂d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO的转化率为__________。
(3)图(a)表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。


(a)(b)
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:______________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期第二次月考化学试卷 题型:计算题
国家规定,酿造食醋的总酸含量标准为3.5~5.0g/100mL(总酸含量即100mL食醋中CH3COOH的质量)。某化学兴趣小组为测定某市售食醋的总酸含量,进行了实验.实验后,得知10.0mL该食醋样品与7.5g溶质的质量分数为4%的氢氧化钠溶液恰好完全反应.计算该市售食醋样品中的总酸含量,并说明是否符合国家标准(假设该市售食醋样品中其他物质不与氢氧化钠发生反应)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com