
| A. | 丙炔 | B. | 1-丁炔 | C. | 3-己炔 | D. | 2-庚炔 |
分析 某炔烃与卤素按物质的量为1:2发生加成反应,则该炔烃中含有1个碳碳三键,根据“生成的有机物至少需6mol的卤素单质才能把生成的有机物中的氢全部取代”可知,生成的有机物分子中含有6个氢原子,根据炔烃的通式CnH2n-2,则:2n-2=6,计算出n即可得出结论.
解答 解:某炔烃与卤素按物质的量为1:2发生加成反应,则该炔烃中含有1个碳碳三键,
根据“生成的有机物至少需6mol的卤素单质才能把生成的有机物中的氢全部取代”可知,生成的有机物分子中含有6个氢原子,根据炔烃的通式CnH2n-2,则2n-2=6,
解得:n=4,
所以该炔烃中含有四个C,为丁炔,可能为1-丁炔,
故选B.
点评 本题考查了有机物分子式的确定,题目难度中等,注意掌握常见有机物结构与性质,明确加成反应、取代反应原理及其应用方法,试题培养了学生灵活应用基础知识的能力.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 50 | C. | 5×103 | D. | 104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
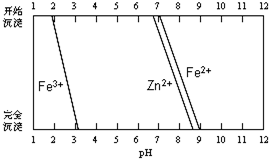
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是共价键 | B. | 一定是离子键 | ||
| C. | 可能是共价键,也可能是离子键 | D. | 可能不形成化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:D+>C- | |
| B. | EA2是原子晶体 | |
| C. | A和B形成的原子个数比为1:1的化合物分子是非极性分子 | |
| D. | 以上元素中形成的最高价氧化物对应的水化物酸性最强的是C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com